题目内容
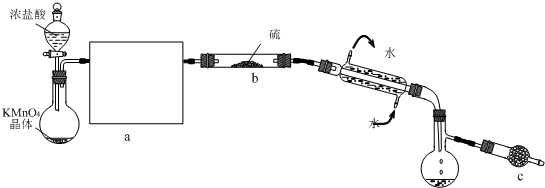
S2Cl2是一种金黄色易挥发的液体(熔点:-76 ℃,沸点:138 ℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们常用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发黏冷变硬的不良性能。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
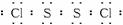
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式:____________________。
(2)装置a中应放的试剂为,其作用是___________________________________;装置c为何水平放置____________________________;装置d的名称是________________,它的作用是______________________________________。
(3)该实验的操作顺序应为___________(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)图中f装置中应放置的试剂为,其作用是___________________________________。
(1)![]()
(2)浓H2SO4 干燥Cl2 防止熔融的硫堵塞导管 冷凝管 使生成的S2Cl2冷凝成液体
(3)②③①⑤④(或③②①⑤④)
(4)碱石灰 吸收尾气,防止空气中的水汽使S2Cl2水解
解析:装置c水平放置是为了防止熔融的硫堵塞导管而造成爆炸等危险,装置f中放置碱石灰,吸收Cl2,防止对大气造成污染,也可以吸收空气中的水汽,防止S2Cl2水解。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目