题目内容
【题目】工业上利用脱硫后的天然气合成氨的某流程如下:
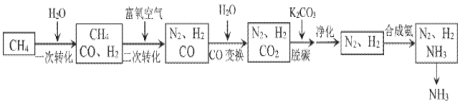
(1)“一次转化”中H2O(g)过量的目的是______。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为______。
(3)“CO变换”的反应是CO(g)+H2O(g)CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于______。
(4)“脱碳”后的溶液再生的方法是______(以化学方程式表示)。
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq),△H<0。充分吸收CO采取的措施是______(选填序号)。
a 升温b 降温c 加压d 减压
(6)已知N2(g)+3H2(g)2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:

①T1______T2(填“>”、“=”或“<”)。
②a点总压为50Mpa,T2时Kp=______(Mpa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是______
a 加压b 使用催化剂c 增大氢氮比d 分离NH3
【答案】增大CH4的平衡转化率 2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70kJmol-1 9:1 KHCO3![]() K2CO3+CO2↑+H2O bc > 3.7×10-4 ad
K2CO3+CO2↑+H2O bc > 3.7×10-4 ad
【解析】
(1)增大反应物浓度,平衡正向移动,提高另一原料的利用率或平衡转化率;
(2)依据盖斯定律计算;
(3)由题给条件建立如下三段式计算;
(4)“脱碳”原料为K2CO3,“脱碳”后的溶液为KHCO3或KHCO3、K2CO3混合溶液;
(5)反应[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq)正向是体积减小的反应;
(6)①分析反应图象可知,平衡后,其它条件相同时,T2温度下生成物NH3的体积分数大于T1,而合成氨反应正向放热;
②由题给条件建立如下三段式计算;
③压缩气体增大压强、增大c(N2)等既能加快反应速率,又能提高H2平衡转化率;催化剂只加快反应速率,不改变反应进程,平衡不移动;增大氢氮比,相当增大c(H2),反应正向进行;
(1)增大反应物浓度,平衡正向移动,提高另一原料的利用率或平衡转化率,所以“一次转化”中H2O(g)过量的目的是增大CH4的平衡转化率,故答案为:增大CH4的平衡转化率;
(2)已知反应①2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1②2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1,由盖斯定律③×2-②-①×2有CH4和O2反应生成CO和H2的热化学方程式为2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=(-802kJmol-1)×2-(-566kJmol-1)-(-484kJmol-1)×2=-70kJmol-1,故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70kJmol-1;
(3)设起始时c(H2O)=a,c(CO)=1mol/L,由题给条件建立如下三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
起始浓度(mol/L) 1 a 0 0
变化浓度(mol/L) 0.9 0.9 0.9 0.9
平衡浓度(mol/L) 0.1a-0.9 0.9 0.9
则平衡常数K=![]() =
=![]() =1,解得a=9mol/L,所以CO的转化率达到90%,起始时c(H2O):c(CO)≥9:1,故答案为:9:1;
=1,解得a=9mol/L,所以CO的转化率达到90%,起始时c(H2O):c(CO)≥9:1,故答案为:9:1;
(4)“脱碳”原料为K2CO3,“脱碳”后的溶液为KHCO3或KHCO3、K2CO3混合溶液,KHCO3对热不稳定,加热可转化为K2CO3重复使用,反应的化学方程式为KHCO3![]() K2CO3+CO2↑+H2O,故答案为:KHCO3
K2CO3+CO2↑+H2O,故答案为:KHCO3![]() K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;
(5)反应[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq)正向是体积减小的反应,增大压强、降低温度均可使反应正向进行提高CO的利用率,bc正确,故答案为:bc;
(6)①分析反应图象可知,平衡后,其它条件相同时,T2温度下生成物NH3的体积分数大于T1,而合成氨反应正向放热,达到平衡后,升高温度时平衡逆向进行、氨气的体积分数降低,并且温度越高、氨气的体积分数越小,所以T1>T2,故答案为:>;
②a点坐标为(3,0.2),设n(N2)=1mol,则n(H2)=3mol,反应的三段式为
N2(g)+3H2(g)2NH3(g)
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x3-3x2x
NH3的体积分数=![]() =0.2,解得x=
=0.2,解得x=![]() ,p(N2)=
,p(N2)=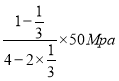 =10Mpa,p(H2)=30Mpa,p(NH3)=10Mpa,压强平衡常数Kp=
=10Mpa,p(H2)=30Mpa,p(NH3)=10Mpa,压强平衡常数Kp=![]() =
=![]() =
=![]() (Mpa)-2=3.7×10-4(Mpa)-2,故答案为:3.7×10-4;
(Mpa)-2=3.7×10-4(Mpa)-2,故答案为:3.7×10-4;
③压缩气体增大压强、增大c(N2)等既能加快反应速率,又能提高H2平衡转化率,结合速率方程可知c(NH3)越小,反应速率越大,并且分离氨气,平衡正向移动可提高;催化剂只加快反应速率,不改变反应进程,不能提高H2平衡转化率;增大氢氮比,相当增大c(H2),反应正向进行,但H2平衡转化率降低,所以既能加快反应速率,又能提高H2平衡转化率的措施为ac,故答案为:ac。

【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小