题目内容
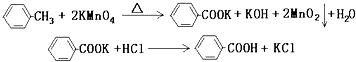
【题目】已知MnO2和浓盐酸加热可以制取Cl2,某化学研究性学习小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华。

请回答下列问题
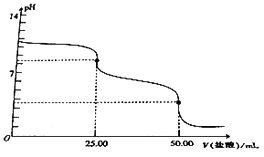
(1)制备开始时A 装置烧瓶中产生的现象为_____;发生反应的离子 方程式为_____________________。
(2)按气流方向连接完整转置:a→___→___→___→___→b→c→___→___(填仪器接口字母编号)。____
(3)装置E的作用是_______;B装置硬质政璃管内导管口处棉花的作用是_________________。
(4)若无C装置可能产生的后果是________________________________。
(5)本实验合理的操作步骤为_____________________________(按操作顺序选择序号)
①添加药品②连接仪器③检查装置气密性④点燃A处酒精灯⑤点燃B处酒精灯⑥使B中硬质玻璃管内充满黄绿色气体
【答案】 溶液中有气泡冒出,烧瓶内充满黄绿色气体 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O h i d e f g 吸收氯气中的水蒸气 防止固体粉末堵塞导管口 反应完的Cl2污染空气、空气中的H2O 可使无水FeCl3水解 ②③①④⑥⑤
Mn2++Cl2↑+2H2O h i d e f g 吸收氯气中的水蒸气 防止固体粉末堵塞导管口 反应完的Cl2污染空气、空气中的H2O 可使无水FeCl3水解 ②③①④⑥⑤
【解析】(1).浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水,现象为:溶液中有气泡冒出,烧瓶内充满黄绿色气体,该反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:溶液中有气泡冒出,烧瓶内充满黄绿色气体;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:溶液中有气泡冒出,烧瓶内充满黄绿色气体;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2). 制备无水FeCl3需要经过如下步骤:制备氯气、除去氯化氢、干燥氯气、制备氯化铁、防止空气中水蒸气进入硬质试管及尾气处理,洗气时应长进短出,所以正确的顺序为:a→h→i→d→e→b→c→f→g,故答案为:h i d e f g;
(3)E装置中盛装的是浓硫酸,结合上述分析可知,该装置是用于除去氯气中的水蒸气;铁粉和氯化铁是固体物质,气流通过时可能会有固体堵塞导管口,所以棉花的作用是防止固体粉末堵塞导管口,故答案为:吸收氯气中的水蒸气;防止固体粉末堵塞导管口;
(4).C装置主要用于尾气处理和防止空气中的水蒸气进入B装置中使氯化铁水解,故若无C装置可能产生的后果是:反应完的Cl2污染空气、空气中的H2O可使无水FeCl3水解;
(5).本实验包括气体的制备和物质的制备,气体制备需要先连接装置,再检验装置气密性,然后添加药品,开始制备氯气,即加热A处酒精灯,然后排空气,并使B中充满氯气,开始制备氯化铁,即加热B处酒精灯,所以步骤为②③①④⑥⑤,故答案为:②③①④⑥⑤。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】下列各组物质中,不满足如图所示转化关系的是( )
选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | Cl2 | N2 | H2 |
B | Fe | H2O | Fe2O3 | CO |
C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
D | Br2 | FeCl2 | FeBr3 | Cl2 |
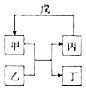
A.A
B.B
C.C
D.D