题目内容
17.某溶液中大量存在的五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )| A. | Na+ | B. | Mg2+ | C. | CO32- | D. | Ba2+ |
分析 n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,根据溶液不显电性,可以确定M为阳离子,根据电荷守恒判断M离子所带电荷,然后根据离子能否大量共存判断可能存在的离子.
解答 解:离子所带电离:3n(Fe3+)+n(H+)×1=3×1+3=6,2n(SO42-)+n(NO3-)×1=2×3+2×1=8,根据溶液不显电性,可以确定M为阳离子,M所带电荷为:$\frac{8-6}{1}$=+2,即:M为带两个单位正电荷的阳离子,又SO42-与Ba2+反应生成硫酸钡沉淀,所以M为Mg2+,故选B.
点评 本题考查物质的量有关计算、离子共存,关键是利用电荷守恒进行计算,为易错题目,学生容易忽略离子共存问题,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知:Fe3+遇到KSCN溶液显血红色,茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
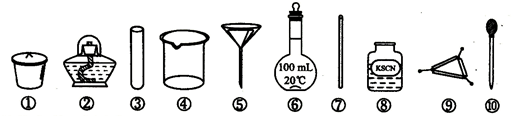

| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
5.已知合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,在特定条件下,其反应的速率与参加反应的物质的浓度的关系式为v=k c(N2)•c1.5(H2)•c-1(NH3).欲既要使合成氨的产率增大,又要使反应速率加快,可采取的方法是( )
| A. | 升高反应温度 | B. | 及时从平衡混合气体中分离出NH3 | ||
| C. | 使用催化剂 | D. | 减小压强 |
12.某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题.
指出实验①和③实验中的实验现象:a:有白色沉淀生成,b:有气泡产生;
分别写出实验①和③的离子反应方程式:实验①Ag++Cl-=AgCl↓;实验③CO32-+2H+=CO2↑+H2O.
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸造成的,你是否同意这个观点不同意,(填“同意”或“不同意”).理由是次氯酸的酸性比碳酸的酸性弱,不能和Na2CO3反应.
(3)在分析实验②现象产生的原因时,他们出现了分歧.甲同学认为氯水加入到NaOH溶液中发生了中和反应而使溶液褪色,乙同学认为氯水中含有次氯酸具有漂白性而使溶液褪色.请你设计简单实验证明他们的观点谁正确向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | a:有白色沉淀生成 | 氯水中含有Cl- |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | 红色溶液变为无色 | |
| ③ | 将氯水滴加到Na2CO3溶液中 | b:有气泡产生 | 氯水中含有H+ |
分别写出实验①和③的离子反应方程式:实验①Ag++Cl-=AgCl↓;实验③CO32-+2H+=CO2↑+H2O.
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸造成的,你是否同意这个观点不同意,(填“同意”或“不同意”).理由是次氯酸的酸性比碳酸的酸性弱,不能和Na2CO3反应.
(3)在分析实验②现象产生的原因时,他们出现了分歧.甲同学认为氯水加入到NaOH溶液中发生了中和反应而使溶液褪色,乙同学认为氯水中含有次氯酸具有漂白性而使溶液褪色.请你设计简单实验证明他们的观点谁正确向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确.
6.水是人类生活不可缺少的物质,随着工农业生产的不断发展,越来越多的地区出现水资源的缺乏,已知水的相对分子质量是18,则一个水分子的质量为( )
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18g•mo{l}^{-1}}{{N}_{A}}$ | C. | 18NAg | D. | $\frac{18g}{{N}_{A}}$ |
