题目内容
8.10g碳酸钙与足量盐酸反应,消耗HCl的物质的量为多少?生成二氧化碳气体的体积(标准状况)为多少?分析 发生反应:CaCO3+2HCl═CaCl2+H2O+CO2↑,根据n=$\frac{m}{M}$计算碳酸钙物质的量,根据方程式计算消耗HCl物质的量、生成二氧化碳物质的量,再根据V=nVm计算二氧化碳的体积.
解答 解:10g碳酸钙物质的量为$\frac{10g}{100g/mol}$=0.1mol,
设消耗HCl物质的量、生成二氧化碳物质的量分别为x、y,则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 2 1
0.1mol x y
故x=$\frac{0.1mol×2}{1}$=0.2mol,y=$\frac{0.1mol×1}{1}$=0.1mol
故标况下生成二氧化碳的体积为0.1mol×22.4L/mol=2.24L,
答:消耗HCl的物质的量为0.2mol,标况下生成二氧化碳气体的体积为2.24L.
点评 本题考查化学方程式有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 按系统命名法,化合物 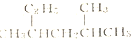 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. | 等质量的甲烷、乙烯、乙炔分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 苯酚、水杨酸(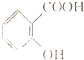 )和苯甲酸都是同系物 )和苯甲酸都是同系物 | |
| D. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 |
19.准确量取25.00mL高锰酸钾溶液,可选用的仪器是( )
| A. | 50 mL量筒 | B. | 10 mL量筒 | C. | 50 mL酸式滴定管 | D. | 50 mL碱式滴定管 |
16.在南方人们的主食是大米,在进食时,我们将米饭在嘴中长时间嚼为什么感觉到有甜味呢( )
| A. | 淀粉在唾液淀粉酶的作用下转变成麦芽糖 | |
| B. | 淀粉中含有葡萄糖 | |
| C. | 淀粉在唾液淀粉酶的作用下转变成葡萄糖 | |
| D. | 淀粉是糖类物质有甜味 |
13.下列热化学方程式及说法正确的是( )
| A. | CH4(g)+2O2 (g)=CO2(g)+2H2O(l)△H=-890KJ | |
| B. | 丁烷的燃烧热是2878 kJ/mol,则:C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(g)△H=-2878kJ/mol | |
| C. | 2 mol氢气燃烧生成水蒸气放出484 kJ热量,则:H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242 kJ•mol-1 | |
| D. | CH3COOH(aq)+KOH(aq)=CH3COOK(aq)+H2O(l)△H=-akJ•mol-1,a为中和热的值 |
20.想一想:氢氧化钡(液态)、硫酸铜(固态)、纯碱(固态)这些物质为什么归为一类,下列哪种物质还可以和它们归为一类( )
| A. | C2H5OH(液态) | B. | 盐酸 | C. | 氯化钠溶液 | D. | 豆浆 |
17.某溶液中大量存在的五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )
| A. | Na+ | B. | Mg2+ | C. | CO32- | D. | Ba2+ |
12.除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| B. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| C. | NaCl溶液(Br2):加CCl4,萃取分液 | |
| D. | KNO3溶液(NaCl):加热蒸发得浓溶液后,降温 |