题目内容
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+ B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl- D. 根据以上实验,无法确定该固体中有Na+
【答案】A
【解析】(1)一份固体溶于水得无色透明溶液,一定不含Cu2+;加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀,4.66g沉淀为硫酸钡,物质的量为![]() =0.02mol,即n(SO42-)=0.02mol,沉淀部分溶于盐酸,一定含有CO32-、SO42-,碳酸钡沉淀质量为6.63g-4.66g=1.97g,物质的量为0.01mol,即n(CO32-)=0.01mol;(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L(标准状况),物质的量为
=0.02mol,即n(SO42-)=0.02mol,沉淀部分溶于盐酸,一定含有CO32-、SO42-,碳酸钡沉淀质量为6.63g-4.66g=1.97g,物质的量为0.01mol,即n(CO32-)=0.01mol;(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L(标准状况),物质的量为![]() =0.03mol,所以含有铵根离子0.03mol;根据电荷守恒,阴离子所带负电荷的物质的量=0.02mol×2+0.01mol×2=0.06mol,阳离子所带正电荷的物质的量=0.03mol×1=0.03mol,所以一定含有钠离子,其物质的量是:0.06mol-0.03mol=0.03mol;A、该固体中一定含有NH4+、CO32-、SO42-、Na+,故A正确;B、该固体中一定没有Cu2+、故B错误;C、该固体中一定含有NH4+、CO32-、SO42-、Na+,其余的无法判断,故C错误;D、根据以上实验,该固体中一定有Na+,故D错误;故选A。
=0.03mol,所以含有铵根离子0.03mol;根据电荷守恒,阴离子所带负电荷的物质的量=0.02mol×2+0.01mol×2=0.06mol,阳离子所带正电荷的物质的量=0.03mol×1=0.03mol,所以一定含有钠离子,其物质的量是:0.06mol-0.03mol=0.03mol;A、该固体中一定含有NH4+、CO32-、SO42-、Na+,故A正确;B、该固体中一定没有Cu2+、故B错误;C、该固体中一定含有NH4+、CO32-、SO42-、Na+,其余的无法判断,故C错误;D、根据以上实验,该固体中一定有Na+,故D错误;故选A。

【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C===C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出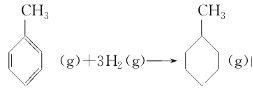 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥