题目内容
【题目】将6.5g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)写出反应的化学方程式并用双线桥标出电子转移的方向和数目________;
(2) 所用盐酸中HCl的物质的量;____
(3)反应中生成的H2在标准状况下的体积。____
【答案】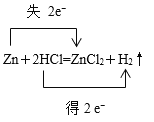 0.2mol 2.24L
0.2mol 2.24L
【解析】
(1)Zn与盐酸反应方程式为Zn+2HCl=ZnCl2+H2↑,1molZn参与反应,转移2mol电子,用双线桥表示电子转移的方向和数目: ;
;
(2)Zn+2HCl=ZnCl2+H2↑
65g 2mol 1mol
6.5g n(HCl) n(H2)
n(HCl)=6.5g×2mol÷65g=0.2mol;
(3)根据(2),n(H2)=0.1mol,即标准状况下V(H2)=0.1mol×22.4L·mol-1=2.24L。

练习册系列答案
相关题目