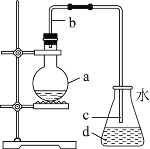
题目内容
【题目】下列溶液一定呈中性的是:
A.pH=7的溶液B.Kw=1.0×10-14的溶液
C.c2(OH-)=KwD.pH=3的酸与pH=11的碱等体积混合后的溶液
【答案】C
【解析】
A. 常温下,pH=7的溶液呈中性,由于水的电离是吸热反应,温度降低,水的电离程度减小,所以pH=7的溶液中,氢离子浓度不一定等于氢氧根离子浓度,A项错误;
B. Kw与温度有关,在常温下,不管溶液呈酸性、碱性还是中性,Kw=1.0×10-14,B项错误;
C. 因Kw=c(H+)![]() c(OH-),且c2(OH-)=Kw,则氢离子与氢氧根离子浓度相等,溶液一定显示中性,C项正确;
c(OH-),且c2(OH-)=Kw,则氢离子与氢氧根离子浓度相等,溶液一定显示中性,C项正确;
D. pH=3的酸与pH=11碱等体积混合后的溶液,酸碱的情况不知道,不能确定反应后的溶液中c(H+)、c(OH-)相对大小关系,无法判断是否显示中性,D项错误;
答案选C。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
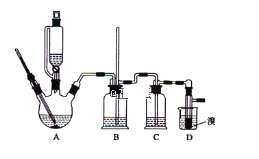
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。