题目内容
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
(1)N2H4中的N原子可达到8电子的稳定结构,画出N2H4的结构式_____________。
(2)实验室用两种固体制取NH3的反应方程式为______________________________。
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
(4)肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(5)肼是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942,O=O为500,N-N为154,则断裂1molN-H键所需的能量是 kJ。
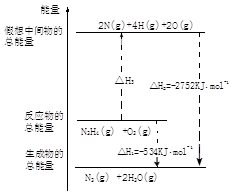
(1)N2H4中的N原子可达到8电子的稳定结构,画出N2H4的结构式_____________。
(2)实验室用两种固体制取NH3的反应方程式为______________________________。
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
(4)肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(5)肼是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942,O=O为500,N-N为154,则断裂1molN-H键所需的能量是 kJ。
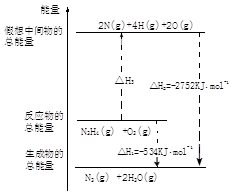
(1) (2)2NH4Cl+Ca(OH)2
(2)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2(3) 2NH3+NaClO=N2 H4+NaCl+H2O (4)N2H4-4e—+4OH—=N2+4H2O (5)391
2NH3↑+2H2O+CaCl2(3) 2NH3+NaClO=N2 H4+NaCl+H2O (4)N2H4-4e—+4OH—=N2+4H2O (5)391
 (2)2NH4Cl+Ca(OH)2
(2)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2(3) 2NH3+NaClO=N2 H4+NaCl+H2O (4)N2H4-4e—+4OH—=N2+4H2O (5)391
2NH3↑+2H2O+CaCl2(3) 2NH3+NaClO=N2 H4+NaCl+H2O (4)N2H4-4e—+4OH—=N2+4H2O (5)391试题分析:(1)N2H4中的N原子可达到8电子的稳定结构,不难画出N2H4的结构式
 。(2)实验室用两种固体制取NH3的反应方程式为2NH4Cl+Ca(OH)2
。(2)实验室用两种固体制取NH3的反应方程式为2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2。(3)根据反应物和生成物,不难写出NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 2NH3+NaClO=N2 H4+NaCl+H2O。(4)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,故答案为:N2H4+4OH--4e-=N2+4H2O;(5)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol-534kJ/mol=2218kJ/mol,设断裂1molN-H键所需的能量为K,即154+4K+500=2218,解得K=391。
2NH3↑+2H2O+CaCl2。(3)根据反应物和生成物,不难写出NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 2NH3+NaClO=N2 H4+NaCl+H2O。(4)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,故答案为:N2H4+4OH--4e-=N2+4H2O;(5)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol-534kJ/mol=2218kJ/mol,设断裂1molN-H键所需的能量为K,即154+4K+500=2218,解得K=391。
练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目


 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积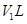 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。