题目内容
随着世界粮食需求量的增加,农业对化学肥料的需求越越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下:
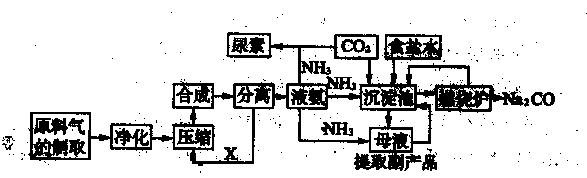
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。

(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。
(1)(2分)合成塔(1分);H2、N2(1分)
(2)(2分)NaCl (1分);使氯化铵逐步从母液中结晶析出(1分)
(3)(2分)NH3 + CO2 + H2O +NaCl = NH4Cl + NaHCO3↓
(4)(2分)加快反应速率同时决定了氧化产物是一氧化氮(1分);
CH4 + 4NO
 2N2 + CO2 + 2H2O (1分)
2N2 + CO2 + 2H2O (1分)试题分析:(1)氮气和氢气的反应在合成塔中进行,因为合成氨反应为可逆反应,反应后化合物中含有一定量的的氮气和氢气 ,分离后再作为原料进行循环利用。
(2)加入氯化钠,利用同离子效应,降低氯化铵的溶解度,使氯化铵结晶析出。
(3)根据流程图和题目所给信息,可知反应物有NH3、CO2、H2O、NaCl,产物为NH4Cl 和 NaHCO3,进而可写出化学方程式。
(4)催化剂的作用为加快化学反应速率,同时生成NO;根据化合价的变化,甲烷将其中的一氧化氮还原为对空气无污染的物质,生成N2、CO2、H2O ,配平可得化学方程式。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目
 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O