题目内容
【题目】![]() ,加水稀释
,加水稀释![]() 的氨水,下列判断正确的是
的氨水,下列判断正确的是
A.原氨水的浓度![]()
B.氨水的电离程度增大,溶液中所有离子的浓度均减小
C.溶液中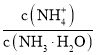 的增大
的增大
D.再加入![]() 的盐酸,混合液
的盐酸,混合液![]()
【答案】C
【解析】
A.一水合氨是弱电解质,氨水中存在电离平衡,![]() 的氨水中
的氨水中![]() ,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于
,氢氧根离子浓度小于氨水浓度,所以氨水浓度大于![]() ,故A错误;
,故A错误;
B.稀释氨水过程中,促进一水合氨电离,氢氧根离子、铵根离子、一水合氨浓度都减小,温度不变,水的离子积常数不变,氢离子浓度增大,故B错误;
C.氨水稀释过程中,促进一水合氨电离,铵根离子数目增大,一水合氨分子数目减小,所以溶液中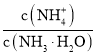 的增大,故C正确;
的增大,故C正确;
D.常温下,![]() 的氨水和
的氨水和![]() 的盐酸,盐酸的物质的量浓度小于氨水,等体积混合时氨水的物质的量大于盐酸的物质的量,所以混合溶液呈碱性,故D错误;
的盐酸,盐酸的物质的量浓度小于氨水,等体积混合时氨水的物质的量大于盐酸的物质的量,所以混合溶液呈碱性,故D错误;
故答案为C。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL![]() 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下![]()
![]() 时,所得溶液中各离子浓度由大到小的顺序为______
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的![]() 醋酸溶液中加水稀释后,下列说法正确的是______.
醋酸溶液中加水稀释后,下列说法正确的是______.
A.溶液中导电粒子的数目减少 ![]() 醋酸的电离程度增大,
醋酸的电离程度增大,![]() 亦增大
亦增大
C.溶液中 不变
不变 ![]() 溶液中
溶液中 减小
减小
(3)①常温下将![]() 稀硫酸
稀硫酸![]() 与
与![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则![]() :
:![]() ______
______![]() 溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由![]() 的HA溶液
的HA溶液![]() 与
与![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,则下列说法正确的是______
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则![]()
B.若![]() ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则![]() 一定大于
一定大于![]()
D.若反应后溶液呈碱性,则![]() 一定小于
一定小于![]()
(4)常温下,浓度均为![]() 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
溶质 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根据表中数据,将浓度均为![]() 的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN![]()
![]()
![]()
②根据以上数据,判断下列反应可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)几种离子开始沉淀时的pH如下表:
离子 |
|
|
|
pH |
|
|
|
当向含相同浓度![]() 、
、![]() 、
、![]() 离子的溶液中滴加NaOH溶液时,______
离子的溶液中滴加NaOH溶液时,______![]() 填离子符号
填离子符号![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.