题目内容
【题目】A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
【答案】[Ar] 3d9 H2O2 sp2 H+﹢HSO3-=H2O﹢SO2  Be+2OH-=BeO22-+H2↑
Be+2OH-=BeO22-+H2↑
【解析】
A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的,则A是H元素;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;则B是O元素,形成的化合物甲是H2O2,乙是H2O;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的,则C是Na元素;D的单质晶体是分子晶体,原子最外层有两个未成对电子,则D是S元素;E位于周期表的ds区,E元素原子最外层有一个未成对电子,则E是Cu元素。
(1)Cu2+的简化电子排布式是[Ar] 3d9;甲、乙分别是H2O2、H2O,由于二者都是分子晶体,分子之间的作用力越大,物质的熔沸点越高,所以沸点较高的是H2O2;
(2)D与B形成常见的具有还原性的阴离子SO32-立体构型是三角锥形;则D显最高正价时与B形成的常见化合物SO3的中心原子的杂化类型是杂化sp2 ;
(3)同时由A、B、C、D四种元素组成的两种盐M和W是NaHSO4、NaHSO3,前者是强酸的酸式盐,起一元强酸的作用,后者是强碱弱酸的酸式盐,二者发生反应产生硫酸钠、水和二氧化硫,这两种盐溶液反应的离子方程式是H+﹢HSO3-=H2O﹢SO2;
(4)由B、D、E三种元素组成常见盐溶液丙是CuSO4,向丙溶液加入过量NaOH溶液可生成[Cu(OH)4]2-,不考虑空间构型,[Cu(OH)4]2-的结构中Cu2+与4个OH-的氧原子之间通过配位键结合,可用示意图表示为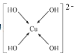 ;
;
(5)根据周期表对角线规则,铍和铝的性质有相似性,铍单质和C的最高正价氧化物对应水化物NaOH溶液发生反应,产生铍酸钠和氢气,反应的离子方程式是Be+2OH-=BeO22-+H2↑。

【题目】根据下列实验现象,所得结论正确的是![]()
实验 | 实验现象 | 结论 |
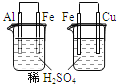
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性: |
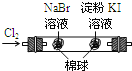
B |
左边棉花变为橙色,右边棉花变为蓝色 | 氧化性: |
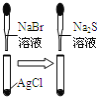
C |
白色固体先变为淡黄色,后变为黑色 | 溶解性: |
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性: |
A.AB.BC.CD.D