题目内容
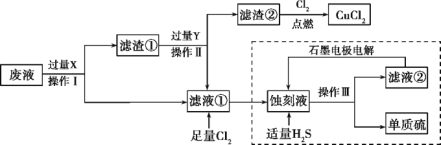
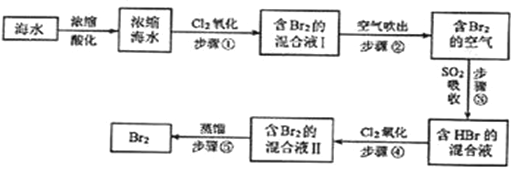
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
【答案】 蒸发 Cl2+2Br﹣=2Cl﹣+Br2 2 C Br2 吸收尾气,防止污染空气
【解析】海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,则
(1)海水通过蒸发浓缩得到浓缩海水,将海水浓缩的方法是蒸发;(2)步骤①是氯气氧化溴离子得到溴单质,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,依据元素化合价变化计算1molCl2参加反应,转移电子物质的量为2mol;(3)通入热空气吹出Br2,利用了Br2的挥发性,故选C;(4)用SO2的水溶液吸收Br2,氧化剂为溴单质,二氧化硫和溴蒸气有毒不能排放到空气中,应进行尾气吸收。

练习册系列答案
相关题目