题目内容
19.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:
Cr2O${\;}_{7}^{2-}$$→_{适量FeSO_{4}溶液}^{①H_{2}SO_{4}溶液}$Cr3+$\stackrel{③调节pH}{→}$Cr(OH)3$\stackrel{③加热}{→}$Cr2O3
有关离子完全沉淀的pH如表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:氯化钠是强电解质,增强溶液导电性.
分析 Ⅰ.(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应;
(2)还原+6价铬应选用还原剂,且不能引进新的杂质;
(3)根据各种碱的性质分析判断,过氧化钠有强氧化性,钡离子和硫酸根离子能生成沉淀;根据完全沉淀对应氢氧化物的PH值判断,溶液的pH值应大于该数值;
Ⅱ.(4)阴极上氢离子放电生成氢气;
(5)水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性.
解答 解:Ⅰ.(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O;
(2)能还原+6价铬,说明加入的物质有还原性,且不能引进新的杂质离子,
A.明矾没有还原性,故错误;
B.铁屑能还原+6价铬,同时本身被氧化成三价铁离子,故正确;
C.生石灰没有还原性,故错误;
D.亚硫酸氢钠能还原+6价铬,同时本身被氧化成硫酸根离子,故正确;
故答案为:BD;
(3)A.Na2O2 有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误;
B.Ba(OH)2 和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误;
C.Ca(OH)2 和 D.NaOH使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确;
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的pH应大于5.6小于9,所以B正确,
故答案为:CD;B;
Ⅱ.(4)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,
故答案为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
(5)水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,
故答案为:氯化钠是强电解质,增强溶液导电性.
点评 本题考查了离子方程式和电极反应式的书写,题目难度中等,离子方程式及电极反应式的书写是学习难点,掌握基础是解题关键.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| B. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| C. | 氢氧燃料电池、丹尼尔电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 纤维素、PLA、纤维二糖、甲壳素、硝化纤维等都是高分子化合物 |
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | 硅为半导体,常用作光导纤维 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为2X=3Y+Z | |
| B. | t时,正、逆反应都不再继续进行,反应达到化学平衡 | |
| C. | 若t=4,则0~t的X的化学反应速率为0.1 mol•L-1•min-1 | |
| D. | 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大 |
| A. | 聚乙烯可以使溴水褪色 | |
| B. | 乙烷与氯气发生取代反应,产物共有7种 | |
| C. | 煤中含有苯、甲苯和二甲苯 | |
| D. | 乙酸和油脂都能与NaOH溶液反应 |
| A. | 氯碱工业中电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 氢氧化钠溶液吸收少量二氧化硫SO2+OH-=HSO3- | |
| D. | 稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
| A. | Na+、Mg2+、Cl-、I- | B. | Fe2+、Ba2+、S2-、Cl- | ||
| C. | Na+、Al3+、Cl-、HCO3- | D. | K+、Fe2+、Cl-、NO3- |
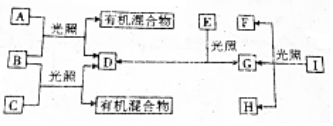
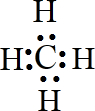 ,有机物C的结构简式为
,有机物C的结构简式为 ,其苯环上的二氯代物共有6种.
,其苯环上的二氯代物共有6种.