题目内容
17.下列说法正确的是( )| A. | 强电解质一定易溶于水 | |
| B. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸的水的电离程度小 | |
| C. | 对可逆反应,升高温度一定存在v(正)>v(逆) | |
| D. | 钢铁在海水中发生电化腐蚀时,铁是正极被氧化 |
分析 A.电解质强弱取决于电离程度,与溶解度无关;
B.增大氢离子的浓度,水的电离平衡逆向移动;
C.对可逆反应,升高温度,若平衡正向移动,v(正)>v(逆);若平衡逆向移动,则则一定存在v(正)<v(逆);
D.钢铁在海水中发生电化腐蚀时,铁作为原电池的负极;
解答 解:A.电解质强弱与溶解度无关,硫酸钡为强电解,但是难溶于水,故A错误;
B.相同浓度时,强酸完全电离,弱酸部分电离,强酸中氢离子的浓度比弱酸中的氢离子浓度大,抑制水的电离,故强酸中水的电离程度比弱酸的水的电离程度小,故B正确;
C.对可逆反应,升高温度,若平衡正向移动,v(正)>v(逆);若平衡逆向移动,则一定存在v(正)<v(逆),故C错误;
D.钢铁在海水中发生电化腐蚀时,铁作为原电池的负极,失去电子,发生氧化反应,被氧化,故D错误;
故选:B.
点评 本题考查强弱电解质与物质溶解性的关系、金属的电化学腐蚀、温度对化学反应速率的影响、水的电离的影响因素等知识点,熟悉相关知识是解题关键,注意金属腐蚀的电化学保护原理,题目难度不大.

练习册系列答案
相关题目
10.下列物质的主要成分不正确的是( )
| A. | 玛瑙:SiO2 | B. | 硫铁矿:FeS | ||
| C. | 漂白精:Ca(ClO)2 | D. | 芒硝:Na2SO4•10H2O |
9.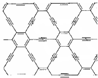 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )| A. | 石墨炔属于芳香烃 | |
| B. | 石墨炔与金刚石互为同素异形体 | |
| C. | 石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
5.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
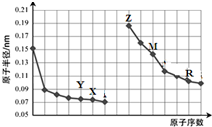

| A. | 简单离子的半径大小比较:Y>X>Z | |
| B. | 气态氢化物稳定性:X>R | |
| C. | R最高价氧化物对应水化物中既有离子键又有共价键 | |
| D. | Z单质能从M的盐溶液中置换出单质M |
12.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如图:甲$\stackrel{试剂A}{→}$乙$\stackrel{试剂A}{→}$丙,下列说法不正确的( )
| A. | 若乙为NaHCO3,则丙一定是CO2 | |
| B. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| C. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 | |
| D. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 |
9.下列溶液中c(Cl-)最大的是( )
| A. | 20mL 0.5mol/L AlCl3溶液 | B. | 30mL 1mol/L KCl溶液 | ||
| C. | 7.5mL 2mol/L MgCl2溶液 | D. | 10mL 3mol/L NaCl溶液 |
6.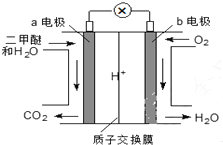 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上反应为O2+2H2O+4e-=4OH- | |
| C. | 电池工作时,若a电极上有1molCH3OCH3放电,电路中有12mol电子转移 | |
| D. | 电池工作时,电池内部H+从a电极移向b电极 |
6.X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,其中X、W的质子数和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第ⅤA族 | |
| B. | Y的一种氢化物不稳定,易分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物可与X的最高价氧化物的水化物反应 |

