题目内容
13.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )| A. | 加催化剂 | B. | 增大压强 | C. | 充入N2 | D. | 降低温度 |
分析 A、催化剂加快反应速率,平衡不移动;
B、正反应是气体体积减小的反应,增大压强平衡正向进行,反应速率加快;
C、加氮气平衡逆向进行;
D、降温速率减小,平衡正向进行,反应速率减慢.
解答 解:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g);△H=-373.4kJ•mol-1 ,反应是放热反应,反应后气体体积减小;
A、催化剂加快反应速率,平衡不移动,一氧化氮转化率不变,故A错误;
B、反应后气体体积减小,增大压强平衡正向进行,反应速率加快,一氧化氮转化率增大,故B正确;
C、加氮气平衡逆向进行;一氧化氮转化率减小,故C错误;
D、降低温度反应速率减小,故D错误;
故选B.
点评 本题考查了化学平衡移动原理的分析应用,主要是催化剂改变速率不改变平衡,转化率是反应物的转化率,题目难度中等.

练习册系列答案
相关题目
4.下列表述正确的是( )
| A. | 羟基的电子式 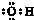 | B. | 醛基的结构简式-COH | ||
| C. | 1-丁烯的键线式  | D. | 聚丙烯的结构简式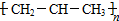 |
1.下列化合物沸点比较错误的是( )
| A. | 丁烷>乙烷>甲烷 | B. | 1-氯戊烷<1-氯丙烷 | ||
| C. | 一氯乙烷>一氟乙烷 | D. | 正戊烷>异戊烷>新戊烷 |
8.关于卤族元素的性质的叙述不正确的是( )
| A. | 它们的原子核外电子层数随核电荷数的增加而增多 | |
| B. | 原子的最外层电子数都是7个 | |
| C. | 它们的单质的颜色随核电荷数的增加而加深 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
18.下列有关说法中正确的是( )
| A. | 第一电离能越大的原子越容易得到电子 | |
| B. | 同周期元素从左到右第一电离能一定增大 | |
| C. | 同周期元素电负性从左到右越来越大 | |
| D. | 金属元素的电负性一定小于非金属元素 |
5.元素的性质呈现周期性变化的根本原因是( )
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 第一电离能呈周期性变化 |
2.已知某原子的结构示意图为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该元素位于第3周期第ⅡA族 | B. | 该元素位于第2周期第Ⅷ族 | ||
| C. | 该元素位于第2周期第ⅡA族 | D. | 该元素位于第4周期第ⅡB族 |
 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分. ②CH3CH2CH(CH3)CH3 ③CH4 ④
②CH3CH2CH(CH3)CH3 ③CH4 ④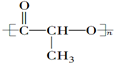 ⑤
⑤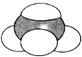 ⑥
⑥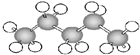 ⑦
⑦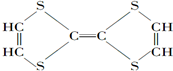
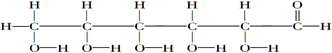
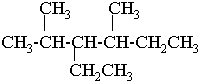
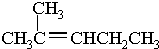 .
.