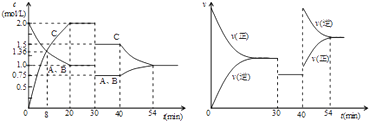
题目内容
【题目】用如图所示装置进行下列实验,能达到实验目的的是( )
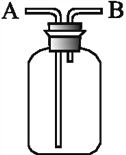
A. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
B. 从B口进气,用排空气法收集SO2
C. 瓶中盛满水,从B口进气,用排水法收集NO2
D. 瓶中盛满水,A口连接导管并伸入量筒中,从B口进气用排水法测量生成NO的体积,
【答案】D
【解析】A、氨气与浓硫酸反应生成硫酸铵,不能用浓硫酸干燥氨气,选项A错误;B、二氧化硫的密度大于空气,应用向上排空气法收集,应从A口进气,选项B错误;C、二氧化氮溶于水并与水反应,不能用排水法收集,选项C错误;D、一氧化氮不溶于水也不与水反应,瓶中盛满水,A口连接导管并伸入量筒中,从B口进气用排水法测量生成NO的体积,选项D正确。答案选D。

【题目】开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算△H= . 反应原料来自煤的气化.已知该反应的平衡常数表达式为K= ![]() ,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为 .
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(molL﹣1) | 0.46 | 1.0 | 1.0 |
此时刻v正v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是 .
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表(填“温度”或“压强”)判断的理由是 
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 ![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因: