题目内容
【题目】开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算△H= . 反应原料来自煤的气化.已知该反应的平衡常数表达式为K= ![]() ,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为 .
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(molL﹣1) | 0.46 | 1.0 | 1.0 |
此时刻v正v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是 .
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表(填“温度”或“压强”)判断的理由是 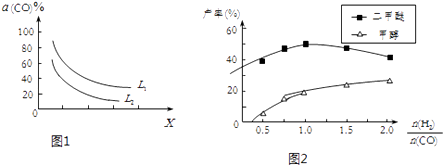
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 ![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
【答案】
(1)﹣262.7kJ?mol﹣1;C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ?mol﹣1
(2)0.075mol?L﹣1?min﹣1
(3)>;1.2mol?L﹣1
(4)温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
(5)当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
【解析】解:(1)①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
依据盖斯定律计算①×2+②+3得到催化反应室中的总反应的热化学方程式:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=﹣262.7kJmol﹣1 ,
产业链中某反应的平衡常数表达式为K= ![]() ,反应的化学方程式为:H2O(g)+C(s)H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1 ,
,反应的化学方程式为:H2O(g)+C(s)H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1 ,
所以答案是:﹣262.7kJmol﹣1 , C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1;(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,
CO(g)+ | 2H2(g) | CH3OH(g) | ||
起始量(mol/L) | 0.6 | 1.4 | 0 | |
变化量(mol/L) | 0.3 | 0.6 | 0.3 | |
8min量(mol/L) | 0.3 | 0.8 | 0.3 |
反应速率v= ![]() =
= ![]() =0.075 molL﹣1min﹣1 ,
=0.075 molL﹣1min﹣1 ,
则8min内H2的平均反应速率为0.075 molL﹣1min﹣1 ,
所以答案是:0.075 molL﹣1min﹣1;(3)①2CH3OH(g)CH3OCH3(g)+H2O(g),浓度商= ![]() =4.7<400,平衡正向移动,则v正 大于 v逆 ,
=4.7<400,平衡正向移动,则v正 大于 v逆 ,
所以答案是:大于;
②设达到平衡时二甲醚反应的物质的量浓度为xmol/L,
该反应
2CH3OH(g) | CH3OCH3(g)+ | H2O | ||
开始(mol/L) | 0.46 | 1 | 1 | |
反应(mol/L) | 2x | x | x | |
平衡(mol/L) | 0.46﹣2x | 1+x | 1+x |
化学平衡常数K= ![]() =400
=400
x=0.2,
则平衡时二甲醚的物质的量浓度=(1+0.2)mol/L=1.2mol/L,
所以答案是:>; 1.2 molL﹣1;(4)3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=﹣262.7kJmol﹣1 , 反应为气体体积减小的放热反应,温度升高平衡逆向进行,一氧化碳转化率减小,增大压强平衡正向进行,一氧化碳转化率增大,图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件,
所以答案是:温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件;(5)图象中曲线变化特征分析,二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小,
所以答案是:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小;
span>【考点精析】本题主要考查了反应速率的定量表示方法和化学平衡状态本质及特征的相关知识点,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生. 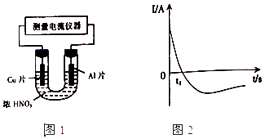
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .