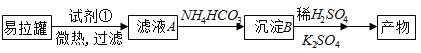题目内容
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
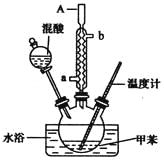
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
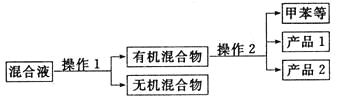
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
【答案】(1)二硝基甲苯、三硝基甲苯(只答三硝基甲苯也给分)(2分)
(2)取一定量浓硝酸于烧杯中,向烧杯里缓缓注入浓硫酸,并用玻璃棒不断搅拌(2分)
(3)(球形)冷凝管(1分)a(1分)
(4)![]() (2分)
(2分)
(5)蒸馏(1分)邻硝基甲苯(1分)
(6)77.5%(2分)
【解析】试题分析:(1)因为甲苯可以和浓硝酸反应生成一硝基甲苯或二硝基甲苯、三硝基甲苯,温度升高,会产生更多的二硝基甲苯或三硝基甲苯等杂质。(2)浓硫酸和浓硝酸的混合注意浓硫酸加入到浓硝酸中,具体过程为取一定量浓硝酸于烧杯中,向烧杯里缓缓注入浓硫酸,并用玻璃棒不断搅拌。(3)仪器A为(球形)冷凝管,从a进水。(4)甲苯和硝酸反应生成对硝基甲苯和水,方程式为:![]() 。(5)分离互溶的有机混合物只能利用沸点不同分离,采用蒸馏的方法。邻硝基甲苯的核磁共振氢谱有5个峰。 (6)甲苯的质量为15×0.866=13克,根据方程式分析理论产生的硝基甲苯的质量为137×13/92=19.4克,则产率为15/19.4=×77.5%。
。(5)分离互溶的有机混合物只能利用沸点不同分离,采用蒸馏的方法。邻硝基甲苯的核磁共振氢谱有5个峰。 (6)甲苯的质量为15×0.866=13克,根据方程式分析理论产生的硝基甲苯的质量为137×13/92=19.4克,则产率为15/19.4=×77.5%。

【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成分是SiO2
D.电解熔融MgCl2,可制得金属镁
【题目】[化学——选修3:物质结构与性质]
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为_________ __________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_ _
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为___ __,孤电子对对数为__ ____
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列___ __式发生。
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是__________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__________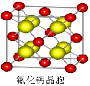 _。
_。