题目内容
【题目】实验室制取硝基苯的主要步骤如下:
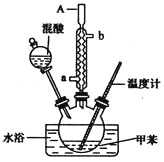
①配制一定比例的浓硫酸和浓硝酸的混合液,加入反应器。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直到反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸和浓硝酸的混合酸时,操作注意事项是
。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是 。
(3)步骤④中洗涤、分离粗硝基苯使用的仪器是 。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 。
(5)实验室制取硝基苯化学方程式 。
【答案】(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却
(2)将反应器放在50~60℃(或回答60℃)的水浴中加热
(3)分液漏斗
(4)除去粗产品中残留的酸(或回答除去残留的硝酸,硫酸)
(5)![]()
【解析】
试题分析:(1)浓硫酸密度大于浓硝酸,浓硫酸与浓硝酸混合放出大量的热,所以配制混酸操作的注意事项是:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
故答案为:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
(2)由于反应物的量不是很多,加热时温度变化幅度较大,为了能有效的控制反应在50℃~60℃下进行,需要将反应器放在50~60℃的水浴中加热。
故答案为:将反应器放在50~60℃(或回答60℃)的水浴中加热;
(3)分离互不相溶的液体采用分液方法分离,使用的仪器是分液漏斗。
故答案为:分液漏斗;
(4)氢氧化钠溶液具有碱性,能中和未反应的酸,所以氢氧化钠的作用是洗去粗产品中未反应的酸性杂
质。
故答案为:除去粗产品中残留的酸(或回答除去残留的硝酸、硫酸);
(5)实验室制取硝基苯的反应,是苯和硝酸的取代反应,化学方程式为:
![]() 。
。
故答案为:![]() 。
。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案