题目内容
下列各溶液中,有关成分的物质的量浓度关系正确的是 (?? )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液:c(NH4Cl)<c[(NH4)2Fe (SO4)2]< c[(NH4)2SO4]
C
【解析】
试题分析:10mL0.5mol·L-1CH3COONa溶液与6mLlmol·L-1盐酸混合,发生反应,相对于溶液中CH3COOH、NaCl、HCl的物质的量浓度之比为5:5:1,所以c(Cl-)>c(Na+),溶液呈酸性,c(H+)>c(OH-),醋酸是弱酸,发生电离,电离程度不大,所以c(Na+)>c(CH3COO-),c(H+)>c(CH3COO-),故为c(Cl-)>c(Na+)>c(H+)>c(CH3COO-)>c(OH-),故A错误;0.1mol·L-1的NaHB溶液pH为4,说明HB-为弱酸根,且HB-电离程度大于其水解程度,电离生成B2-,水解生成H2B,所以c(B2-)>c(H2B),电离与水解程度不大,c(HB-)最大,所以c(HB-)>c(B2-)>c(H2B),故B错误;硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性,铵根离子有剩余,溶液为硫酸钠、硫酸铵、氨水的混合溶液,加入的氢氧化钠的物质的量大于硫酸氢铵,所以c(Na+)>c(SO42-),根据物料守恒,n(SO42-)=n(NH4+)+n(NH3·H2O),所以c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;相同pH的(NH4)2SO4与NH4Cl溶液中,硫酸铵和氯化铵都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,即2c[(NH4)2SO4]=c(NH4Cl),亚铁离子抑制铵根离子水解,所以pH相等的(NH4)2SO4溶液, (NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO44]<c(NH4Cl)<c[ (NH4)2Fe (SO4)2],故D错误;故选C。
考点:考查离子浓度大小的比较。

 阅读快车系列答案
阅读快车系列答案(10分)在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答: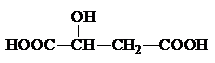 ,该分子中官能团的名称为
,该分子中官能团的名称为

 为_______________________________________。
为_______________________________________。 结构。
结构。