题目内容
10.将钠、镁、铝各0.3mol分别投入200ml 1mol/L的盐酸中,同温同压下产生的气体体积之比是( )| A. | 1:2:3 | B. | 3:2:2 | C. | 3:1:1 | D. | 1:1:1 |
分析 根据反应物的量先判断金属与酸哪种过量,按不足量计算.钠与酸反应完会继续与水反应;
解答 解:将三种金属各0.3mol分别投入200mL 1mol/L的盐酸中,可知三种金属都过量,
应按盐酸的量计算,镁、铝产生氢气物质的量相等,产生氢气的物质的量为:
(0.2L×1mol/L)×$\frac{1}{2}$═0.1 mol.
但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,
钠与水反应产生氢气应按钠的物质的量计算:0.3mol钠产生0.15mol氢气.
故将钠、镁、铝各0.3mol 分别放入100mL 1mol/L的盐酸中,产生氢气的物质的量之比为:
0.15mol:0.1mol:0.1mol═3:2:2,所以同温同压下产生的气体体积比是3:2:2.
故选B.
点评 本题考查金属与酸反应的计算.此类题应先判断谁过量,按不足量计算,同时注意一些活泼金属与酸反应完会继续与水反应.本题易错选D.

练习册系列答案
相关题目
20.食品香精菠萝酯的生产路线(反应条件略去)如下,下列叙述正确是( )

| A. | 可用FeCl3溶液检验步骤(1)产物的是否有苯酚残留 | |
| B. | 可用溴水检验步骤(2)产物中是否有烯丙醇残留 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与溴水发生反应 |
1. 如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
 如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )
如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )| A. | 压缩后U型管内两侧液面仍然保持水平 | |
| B. | 对于2NO2?N2O4平衡体系,向生成N2O4的方向移动 | |
| C. | 左侧气体颜色先变深后逐渐变浅(比原来深) | |
| D. | 若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
18.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 在20 g D216O中含有10NA个电子 | |
| B. | 标准状况下,2.24 L己烷所含分子数为0.1NA | |
| C. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
5.下列各组离子一定能大量共存的是( )
| A. | 在透明溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 在强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| C. | 在强碱性溶液中:Na+、K+、Cl-、NH4+ | |
| D. | 与铝作用产生H2的溶液:Mg2+、K+、Cl-、SO42- |
15.下列说法正确的是( )
| A. | 需要0.2molNaOH固体,在托盘天平上称量时,砝码加上游码的质量等于0.8g | |
| B. | 配制一定物质的量浓度的NaCl溶液,定容时仰视凹液体,会导致溶液的浓度偏低 | |
| C. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| D. | AgCl难溶于水,在水中导电性较差,所以AgCl是非电解质 |
2.下列物质的水溶液中,除水分子外,还存在其他分子的是( )
| A. | HCl | B. | CH3COOH | C. | KNO3 | D. | NaOH |
19.对人体中的所需元素,下列四位同学归纳整理完全正确的一组是( )
| A. | 小芳认为,人体缺乏下列元素,会得不同疾病.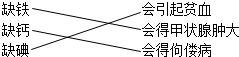 | |
| B. | 小槐搜集资料发现,生活中人们常通过下列途径来补充人体必需的营养元素.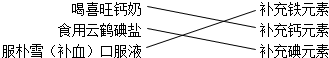 | |
| C. | 小蓉为下列元素各设计了一句广告词来反映其对人体的重要作用. | |
| D. | 小红搜集资料发现,长期或大量摄入铝元素对人体的大脑和神经系统将造成损害,他提出下列建议: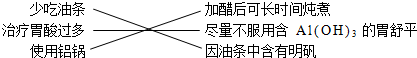 |
16.下列实验能达到预期目的是( )
| A. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| B. | 向淀粉溶液中加入稀硫酸,加热,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜,加热--检验混合物中是否含有甲醛 | |
| D. | 向混有少量乙酸和乙醇杂质的乙酸乙酯中,加入氢氧化钠溶液,然后分液--提纯乙酸乙酯 |