题目内容
16.下列说法错误的是( )| A. | Na2SO3溶液与BaCl2溶液作用,有白色沉淀生成,加盐酸后沉淀消失 | |
| B. | 将SO2气体通入过量Ba(OH)2溶液中,有白色沉淀生成 | |
| C. | 将NO2气体通入KI淀粉溶液,溶液呈蓝色. | |
| D. | 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸. |
分析 A.Na2SO3溶液与BaCl2溶液混合,二者反应生成亚硫酸钡,亚硫酸钡能和稀盐酸发生复分解反应;
B.二氧化硫属于酸性氧化物,能和氢氧化钡反应生成亚硫酸钡白色沉淀;
C.二氧化氮和水反应生成硝酸,硝酸具有强氧化性,能氧化碘离子生成碘;
D.亚硫酸钡易被硝酸氧化生成硫酸钡.
解答 解:A.Na2SO3溶液与BaCl2溶液混合,二者反应生成亚硫酸钡,亚硫酸钡能和稀盐酸发生复分解反应生成氯化钡、二氧化硫和水,所以加盐酸后沉淀消失,故A正确;
B.二氧化硫属于酸性氧化物,能和氢氧化钡反应生成亚硫酸钡白色沉淀,所以有白色沉淀生成,故B正确;
C.二氧化氮和水反应生成硝酸,硝酸具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以溶液呈蓝色,故C正确;
D.亚硫酸钡易被硝酸氧化生成硫酸钡,所以不能用硝酸酸化的氯化钡检验亚硫酸钠是否变质,应该用盐酸酸化的氯化钡溶液检验是否变质,故D错误;
故选D.
点评 本题考查二氧化硫性质,二氧化硫具有还原性、氧化性和漂白性,注意二氧化硫漂白性具有短暂性特点,具有可逆性,二氧化硫能被强氧化剂氧化,题目难度不大.

练习册系列答案
相关题目
7.下列热化学方程式中△H代表燃烧热的是( )
| A. | CH4 ( g )+3/2O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+3/2O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
4.下列物质在固体状态时,所有原子的最外层都满足8电子结构且属于分子晶体的是( )
| A. | NH4Cl | B. | H2O | C. | SiO2 | D. | PCl3 |
1.下列方法能使电离平衡H2O?H++OH-向左移动的是( )
| A. | 向水中加入少量氢氧化钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量碳酸钠固体 | D. | 将水加热到100℃,使水的pH=6 |
8.鉴别NO2和溴蒸气的方法不正确的是( )
| A. | 用四氯化碳溶液 | B. | 用湿润的淀粉碘化钾试纸 | ||
| C. | 用硝酸银溶液 | D. | 用蒸馏水 |
6.下列说法不正确的是( )
| A. | 硫酸的摩尔质量(g/mo1)与6.02×1023个磷酸分子的质量(g)在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个O2的质量比等于7:8 | |
| C. | 3.2gO2所含的原子数目约为0.2×6.02×1023个 | |
| D. | 常温、常压下,0.5×6.02×1023个二氧化碳分子的质量是44g |

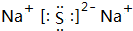 ,属于离子晶体
,属于离子晶体