题目内容
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
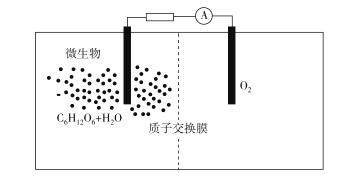
A. 负极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 正极反应式为O2+4e-+2H2O=4OH-
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
【答案】C
【解析】
根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为上C6H12O6+6H2O24e=6CO2+24H+,正极的电极反应式为O2+4e-+4H+=2 H2O。
A.根据上述分析可知,负极的电极反应式为上C6H12O6+6H2O24e=6CO2+24H+,因此CO2在负极产生,A项正确;
B. 葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,B项正确;
C. 根据上述分析可知,正极反应式为O2+4e-+4H+=2 H2O,C项错误;
D. 该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2===6CO2+6H2O,D项正确;
答案选C。

【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
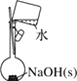
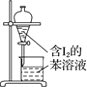
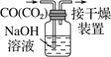
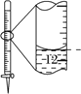
【题目】下列有关实验的选项正确的是
|
|
|
|
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D
【题目】在2 L密闭容器中进行反应:aX(s)+bY(g)![]() cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | P | Q |
起始/mol | 0.5 | 1.0 | 1.5 | |
2min末/mol | 0.7 | 2.7 | 0.8 | |
3min末/mol | 2.7 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,v(P)∶v(Y)=2∶5。
(1)试确定以下物质的相关量:起始时n(Y)=______,2min末时n(Q)=______。
(2)上述反应的化学方程式为_________
(3)用Y表示2 min内的反应速率为______。2min末,Q在混合气体的体积分数为_____
(4)在保持温度和容积不变的情况下,下列关于上述反应的叙述不正确的是_____
a.2 min内用X表示的反应速率为0.05mol·L-1·min-1
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡