题目内容
(8分)已知A、B、C三种元素均为第二周期非金属元素,其原子序数依次增大,且它们之间可以形成分子式为AC、BC、AC2和BC2的四种常见化合物。A、B、C可分别与氢原子形成电子总数相等的分子。
请回答下列问题:
(1)写出A、B、C三种元素的元素符号:A________,B________,C________。
(2)AC2的电子式为____________________________________________________。
(3)氢原子可以与A、B、C分别形成两组电子总数相等的分子,其电子总数分别为________和________。
(4)由1个A原子、2个B原子、1个C原子与4个氢原子构成的分子中,每个原子最外层均达到稳定结构,该分子的结构简式为________。
(1)C N O (2)······C······ (3)10 18 (4) 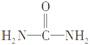 2
2
【解析】由条件分析可知A、B、C分别为C、N、O,C、N、O分别与氢原子形成电子总数相等的分子有两组,一组是CH4、NH3、H2O,另一组是C2H6、N2H4、H2O2,其电子总数分别为10和18,由1个碳原子、2个氮原子、1个氧原子与4个氢原子构成的分子中各原子最外层要达到稳定结构,构成的分子只能是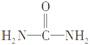 。
。

(分)已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
| …… | A | ||||||
| B | C | D |
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是 周期 族;D的电子排布式为: 。
(2)A和D的氢化物中,沸点较高的是 ,原因是
;A和B的离子中,半径较小的是 (填离子符号)。
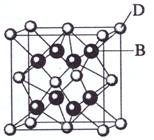
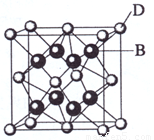
 (3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。
(3) A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如右图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是 。
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
 (1)写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;
(1)写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;