题目内容
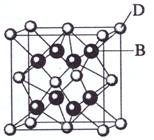
(共15分)已知A、B、C、D和E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图。请回答:
(1)写出B的电子排布图 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是 ;
(2)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 :
(3)写出C的单质与水反应的化学方程式 ;
(4)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
(共15分)
(1)略(1分) Cl(1分)
在氟化氢分子中存在氢键,分子间作用力大,破坏其作用力需要的温度较高,而氯化氢中不存在氢键,所以氟化氢的沸点高于氯化氢的沸点。(2分)
(2)4 Ⅷ 铁 1s22s22p63s23p63d6(各1分)
(3)Cl2+H2O=HCl+HClO(2分)
(4)CaF2 X射线衍射法(各1分) (8b+4c)/a NA(3分)
解析:

练习册系列答案
相关题目
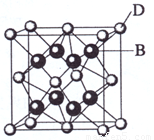
 (1)写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;
(1)写出B的电子排布图
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
;