题目内容
【题目】某同学在实验室研究Na2CO3和NaHCO3的性质及相互转化.
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是 .
②NaHCO3溶液也由无色变为红色,其原因是 .
③比较两份溶液的颜色,红色较浅的是(填化学式).
(2)研究NaHCO3与CaCl2的反应.
实验序号 | 实验操作 | 实验现象 |
实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
①实验1中没有出现白色浑浊的原因是 .
②实验2中形成的分散系属于 .
③用离子方程式表示实验2中发生的反应 .
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略). 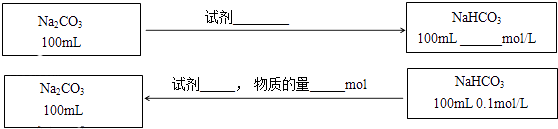
【答案】
(1)CO32﹣+H2O?HCO3﹣+OH﹣;HCO3﹣+H2O?H2CO3+OH﹣ , HCO3﹣?H++CO32﹣ , 水解程度大于电离程度;NaHCO3
(2)HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致c(Ca2+)?c(CO32﹣)<Ksp(CaCO3);胶体;Ca2++2HCO3﹣=CaCO3↓+CO2+H2O
(3)CO2|0.2|NaOH|0.01
【解析】解:(1.)浓度均为0.1mol/LNa2CO3及NaHCO3溶液中碳酸根离子水解溶液呈碱性,碳酸氢根离子水解程度大于电离程度,所以溶液也呈碱性,相等浓度时,Na2CO3水解产生的氢氧根溶液大于NaHCO3水解产生的氢氧根,所以Na2CO3溶液的碱性强于NaHCO3的溶液,所以有①Na2CO3溶液由无色变为红色,其原因是 CO32﹣+H2OHCO3﹣+OH﹣;②NaHCO3溶液也由无色变为红色,其原因是 HCO3﹣+H2OH2CO3+OH﹣ , HCO3﹣H++CO32﹣ , 水解程度大于电离程度;③比较两份溶液的颜色,红色较浅的是NaHCO3 ,
所以答案是:①CO32﹣+H2OHCO3﹣+OH﹣;②HCO3﹣+H2OH2CO3+OH﹣ , HCO3﹣H++CO32﹣ , 水解程度大于电离程度;③NaHCO3;
(2.)根据题中的实验现象可知,0.001mol/L NaHCO3溶液中电离出的CO32﹣浓度更低,导致c(Ca2+)c(CO32﹣)<Ksp(CaCO3)因而溶液中不出现沉淀,0.1mol/L NaHCO3溶液中电离出的碳酸根离子浓度高一些,与钙离子形成了碳酸钙沉淀及胶体,所以有①实验1中没有出现白色浑浊的原因是 HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致(Ca2+)c(CO32﹣)<Ksp(CaCO3),所以答案是:HCO3﹣浓度低,电离出的CO32﹣浓度更低,导致c(Ca2+)c(CO32﹣)<Ksp(CaCO3);②用激光笔照射,出现光亮的通路为胶体的性质,所以实验2中形成的分散系属于胶体,所以答案是:胶体;③实验2中发生的反应的离子方程式为Ca2++2HCO3﹣=CaCO3↓+CO2+H2O,所以答案是:Ca2++2HCO3﹣=CaCO3↓+CO2+H2O;
(3.)100mL0.1mol/LNa2CO3及中通入CO2生成碳酸氢钠,根据钠元素守恒可知,得到的碳酸氢钠溶液的浓度为0.2mol/L,将100mL0.1mol/LNaHCO3溶液转化为碳酸钠溶液,则加入0.01mol的氢氧化钠固体即可,所以答案是:CO2;0.2;NaOH;0.01.