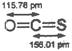
题目内容
下列有关微粒性质的排序中,正确的是( )
| A、元素的非金属性:S>Cl>P>Si | B、元素的原子半径:N<O<F | C、离子半径:Al3+>Mg2+>Na+ | D、沸点:HCl<HBr<HF |
分析:A.同周期从左到右,元素的非金属性逐渐增强;
B.同周期元素从左到右,元素的原子半径逐渐减小;
C.核外电子排布相同的离子,核电荷数越大,离子半径越小;
D.同主族元素的氢化物沸点随相对分子质量增大而增大,有氢键的最大.
B.同周期元素从左到右,元素的原子半径逐渐减小;
C.核外电子排布相同的离子,核电荷数越大,离子半径越小;
D.同主族元素的氢化物沸点随相对分子质量增大而增大,有氢键的最大.
解答:解:A.同周期从左到右,元素的非金属性逐渐增强,所以元素的非金属性:Cl>S>P>Si,故A错误;
B.同周期元素从左到右,元素的原子半径逐渐减小,应为N>O>F,故B错误;
C.三种离子核外电子排布相同,核电荷数越大,则离子半径越小,所以离子半径:Al3+<Mg2+<Na+,故C错误;
D.同主族元素的氢化物沸点随相对分子质量增大而增大,有氢键的最大,所以沸点:HCl<HBr<HF,故D正确.
故选D.
B.同周期元素从左到右,元素的原子半径逐渐减小,应为N>O>F,故B错误;
C.三种离子核外电子排布相同,核电荷数越大,则离子半径越小,所以离子半径:Al3+<Mg2+<Na+,故C错误;
D.同主族元素的氢化物沸点随相对分子质量增大而增大,有氢键的最大,所以沸点:HCl<HBr<HF,故D正确.
故选D.
点评:本题考查元素周期律知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的关系以及比较角度,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
 《物质结构与性质》
《物质结构与性质》

 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答: 。的稳定结构
。的稳定结构 键 h.
键 h. 键
键
 ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。