题目内容
 《物质结构与性质》
《物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是
A
A
(填字母).A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
O=C=S
O=C=S
.光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为平面三角形
平面三角形
(用文字描述).(3)Cu 2+基态的电子排布式为
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为sp3
sp3
,不考虑空间构型,其内界结构可用示意图表示为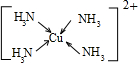

分析:(1)A.同周期自左而右电负性增大;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
D.As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构;
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是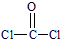 ,分子中C原子采取sp2杂化成键;
,分子中C原子采取sp2杂化成键;
(3)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键.
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
D.As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构;
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是
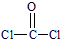 ,分子中C原子采取sp2杂化成键;
,分子中C原子采取sp2杂化成键;(3)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键.
解答:(1)A.同周期自左而右电负性增大,故电负性F>O>N,故A正确;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误;
故选:A;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S,
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是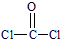 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
故答案为:O=C=S;平面三角形;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ,
,
故答案为:1s22s22p63s23p63d9;sp3; .
.
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误;
故选:A;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S,
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是
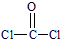 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,故答案为:O=C=S;平面三角形;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为
 ,
,故答案为:1s22s22p63s23p63d9;sp3;
 .
.点评:本题综合性较大,涉及电离能、电负性、晶胞结构、等电子体、杂化轨道、配位键、核外电子排布规律等,难度中等,注意等电子体中价层电子数相同的微粒具有相似的结构.

练习册系列答案
相关题目
【化学--选修3:物质结构与性质】
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
回答下列问题:
(1)B元素原子核外已成对电子数是未成对电子数的 倍.
(2)X、Y、Z的电负性从大到小的顺序为 (用元素符号表示).
(3)分子式为A2B、A2E的两种物质中 更稳定(用化学式表示),原因是 .
(4)X的氯化物的熔点比Y的氯化物的熔点 ,原因是 .
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为 .等电子体指的是原子总数相同.价电子总数相同的分子.离子或基团,据此定义写出离子SCN-的一种等电子体 .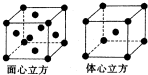
(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为 .F元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示.在面心立方晶胞中F原子的配位数为 ,体心立方晶胞的密度可表示为 .(F的原子半径为r)
已知:①A的简单阴离子核外有2个电子,B元素原子最外层电子数是内层电子数的3倍,E原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体,F元素原子序数为26.
②X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
(1)B元素原子核外已成对电子数是未成对电子数的
(2)X、Y、Z的电负性从大到小的顺序为
(3)分子式为A2B、A2E的两种物质中
(4)X的氯化物的熔点比Y的氯化物的熔点
(5)F的氯化物FCl3与KSCN溶液反应显红色,该反应的离子方程式为

(6)F的一种常见配合物F(CO)3常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断F(CO)3的晶体类型为