题目内容
【化学——选修物质结构与性质】(15分)第(6)题第一空为1分,其余为2分
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S + ZnO ="=" ZnS + H2O; C2H5SH + ZnO ="=" ZnS + C2H4 + H2O;
C2H5SH + H2 ="=" C2H6 + H2S; COS + H2 ="=" CO + H2S; CS2 + 4H2 ="=" CH4+ 2H2S
(1)钴原子在基态时核外电子排布式为________________________。
(2)下列有关分子结构的说法正确的是_______________(填字母)。
A.C2H4分子中有5个σ键和1个π键
B.COS分子(结构如右图)中键能C=O>C=S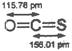
C.H2S分子呈V形结构 D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是____________________(填字母)。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:CS2>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)β-ZnS的晶胞结构如右图,晶胞中S2-数目为_________个。S2的配位数是_______________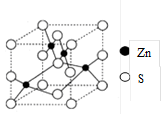
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于_____________________________________________________________。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]?8H2O,中心原子的配位数为_____________________。写出与CN—的电性相同,结构相似的一种微粒的电子式_________________
第(6)题第一空为1分,其余为2分(1)[Ar]3d74s2或1s22s22p63s23p63d74s2
(2)ABCD(漏选1—2个得1分,错选或漏选2个以上不得分)(3)C (4)4 4
(5)氧离子半径比硫离子小,晶格能大 (6)8 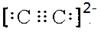
解析试题分析:(1)根据构造原理可知,钴原子在基态时核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2。
(2)单键都是σ键,双键是由1个σ键和1个π键构成的,所以C2H4分子中有5个σ键和1个π键,A正确;氧原子半径小于S原子半径,所以COS分子中键能C=O>C=S,B正确;H2S分子结构和水的类似,呈V形结构,C正确;CH4、C2H6分子中均是单键,所以碳原子均采用sp3杂化,D正确,答案选ABCD。
(3)根据分子的空间构型和键能可知,H2O、CO、COS均是极性分子,A正确;二硫化碳的相对分子质量大于CO2的,所以相同压强下沸点是CS2>CO2,B正确;乙醇分子间存在氢键,则相同压强下沸点是C2H5SH<C2H5OH,选项C不正确;氮气是非极性分子,则相同压强下沸点CO>N2,选项D正确,答案选C。
(4)根据晶胞结构可知,晶胞中S2-数目为4个;同样S2的配位数也是4个。
(5)由于氧离子半径比硫离子小,晶格能大,所以ZnO熔点高于ZnS熔点。
(6)根据配合物化学式Na3[Mo(CN)8]?8H2O可知,中心原子的配位数为8。与CN—的电性相同,结构相似的一种微粒是C22-,则其的电子式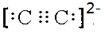 。
。
考点:考查核外电子排布式的书写、共价键、杂化轨道类型、分子空间结构、物质性质以及等电子体的判断和电子式的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题在注重对基础知识巩固和训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 其电子式为
其电子式为