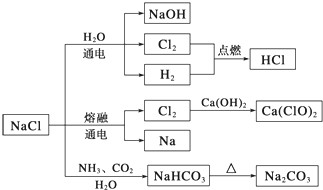
题目内容
【题目】化学与环境密切相关.近年来雾霾问题已成为百姓所关注的主要问题,今年入秋以来,我国大部分地区更是“霾伏”四起,部分地区持续出现中度至重度霾,环境治理刻不容缓。某化学实验小组测得某地区的雾霾中可能含有如下几种无机离子:Na+、NH4+、Mg2+、Al3+、SO42﹣、NO3﹣、Cl﹣。对该地区雾霾处理后获得试样溶液进行了如下的实验:

已知:3NO3﹣ + 8Al + 5OH﹣ + 18H2O ═ 3NH3↑ + 8[Al(OH)4]﹣
请回答下列问题:
(1)试样溶液加入过量NaOH溶液后生成沉淀Ⅰ的化学式是 生成气体Ⅰ的离子方程式为 ,检验该气体的方法是 。
(2)根据实验结果,推测出雾霾中一定含有的离子有 。
(3)若该实验小组测得另一地区雾霾试样中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42-、NO3﹣中的几种。
①若加入锌粒,排空法收集到无色无味气体;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间关系如图所示.
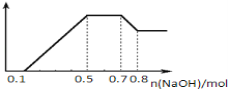
则下列说法不正确的是
A.溶液中一定不含CO32﹣,可能含有NO3﹣和SO42-
B.溶液中n(Mg2+)=0.1mol
C.溶液中的阴离子的物质的量为0.35 mol[
D.n(H+):n(Al3+):n(Mg2+)= 1:1:1
【答案】
(1)Mg(OH)2 NH4++OH﹣![]() NH3↑+H2O;
NH3↑+H2O;
将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气
(2) NH4+、Mg2+、Al3+、NO3﹣
(3)ABD
【解析】
试题分析:试样溶液中加入过量NaOH并加热,生成的气体1,该气体1只能是NH3,则试样中含有NH4+; 由于氢氧化钠过量,故生成的沉淀1为Mg(OH)2,说明原溶液中含Mg2+;如果原溶液中含Al3+,则与过量的氢氧化钠反应转化为了AlO2-,故滤液1中可能含AlO2-、SO42-、NO3-、Cl-,一定含Na+和OH-.则向滤液1中通入CO2,得到溶液2,溶液2中加入Al,生成气体2,根据信息所给的反应NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-;还得到沉淀2,则说明滤液1中含AlO2-,即原溶液中含Al3+。故溶液中一定存在的离子是NH4+、Mg2+、Al3+、NO3-;Na+、SO42-、Cl-的存在不能确定。
(1)试样溶液加入过量NaOH溶液后生成沉淀Ⅰ为Mg(OH)2;气体Ⅰ的生成是溶液中的铵根离子与氢氧根反应生成的:NH4++OH-![]() NH3↑+H2O;由于氨气是唯一的碱性气体,故检验的方法为:将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气。
NH3↑+H2O;由于氨气是唯一的碱性气体,故检验的方法为:将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气。
(2)经过上述分析,雾霾中国一定含有的离子为NH4+、Mg2+、Al3+、NO3-。
(3)若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol,A.由上述分析可知,溶液中一定不含CO32-、NO3-,一定含有SO42-,故A错误;B.n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol,故B错误;C.溶液中的阴离子为硫酸根,根据电荷守恒,物质的量为0.35mol,故C正确;D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误。故答案为:ABD。

 阅读快车系列答案
阅读快车系列答案【题目】下表列出了前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)以上10种元素中,电负性最大的是________(填元素符号)。
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:_________ _____。
②B2C2与EC2反应:____________ ____。
(3)A元素原子核外电子排布图是__ ___;比元素B原子序数大11的元素的原子的电子排布式是 ______。
(4)C和I相比较,非金属性较弱的是_____(填元素名称)。