题目内容
【题目】TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
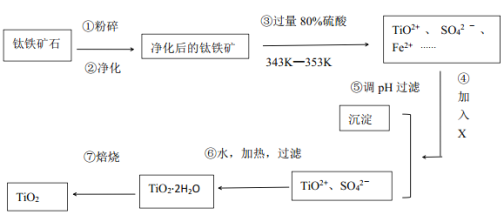
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)写出钛元素在周期表中的位置______________。
净化钛矿石时,是否需要除去杂质FeO?____ ________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:____________________。
(3)④中加入的X可能是( )
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是___________________________。
(5)写出⑥的化学反应方程式_____________________。
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(6)阴极反应的电极反应式为_____________________。
(7)电解过程中需定期向电解槽池中加入碳块的原因是__________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s) +2Cl2 (g)![]() TiCl4(1)+O2 (g) △H= +151 kJ/mol
TiCl4(1)+O2 (g) △H= +151 kJ/mol
所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4。请从反应原理角度说明该反应难进行的原因__________________。
【答案】(1)第四周期IVB族(1分) 不需要(1分)
(2)Al2O3+2OH-=2AlO2-+H2O(2分)(写成四羟基铝酸根也是对的)(3)A(2分)
(4)除去亚铁离子(2分)(5) TiOSO4+2H2O=TiO2·2H2O↓+H2SO4(2分)
(6)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)(2分)
(7)碳单质会与阳极产生的氧气反应而不断减少(2分)
(8)该反应的△H>0,△S<0,反应难自发进行。(2分)
【解析】
试题分析:(1)钛的原子序数是22,在周期表中的位置是第四周期IVB族;氧化亚铁和硫酸反应生成硫酸亚铁,所以净化钛矿石时,不需要除去杂质FeO;
(2)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O ;
(3)要除去亚铁离子,需要首先转化为铁离子,又因为不能引入杂质,所以X试剂应该是双氧水,答案选A。
(4)根据以上分析可知④⑤两步的目的是除去亚铁离子;
(5)根据转化关系图可知反应⑥中反应物是TiOSO4,生成物是TiO2·2H2O ,因此反应的方程式为TiOSO4+2H2O=TiO2·2H2O↓+H2SO4;
(6)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-;
(7)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少,所以电解过程中需定期向电解槽池中加入炭块;
(8)根据方程式可知该反应的△H>0,△S<0,所以依据△G=△H-T△S可知该反应难自发进行。

 阅读快车系列答案
阅读快车系列答案【题目】现有下列短周期元素性质的数据:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
下列说法正确的是
A.原子序数⑦元素大于④元素
B.②、③处于同一周期
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为:![]()