题目内容
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
D
解析试题分析:有图像可知X、Y是反应物,Z是生成物。当反应进行到0.4s时达到平衡。各种物质的物质的量浓度变化是:X:0.3mol/L;Y:01mol/L;Z:0.2mol/L.所以化学方程式是3X+Y 2Z。正确。B.从反应开始到0.4 s时,以Y表示的化学反应速率为(0.2-0.1)mol/L÷0.4s="0.25" mol·L-1·s-1.正确。C.增大压强,物质的浓度增大,所以正逆反应速率均增大。由于该反应的正反应是气体体积减小的反应,增大压强,反应物的浓度增大的多,生成物的浓度增大的少,所以化学平衡会向气体体积减小的方向移动,即平衡向生成Z的方向移动。正确。D.升高温度,化学平衡向吸热反应方向移动,该反应的正反应可能是放热反应,也可能是吸热反应。若为放热反应,则升高温度,平衡逆向移动,平衡常数减小;若为吸热反应,则化学平衡常数增大。错误。
2Z。正确。B.从反应开始到0.4 s时,以Y表示的化学反应速率为(0.2-0.1)mol/L÷0.4s="0.25" mol·L-1·s-1.正确。C.增大压强,物质的浓度增大,所以正逆反应速率均增大。由于该反应的正反应是气体体积减小的反应,增大压强,反应物的浓度增大的多,生成物的浓度增大的少,所以化学平衡会向气体体积减小的方向移动,即平衡向生成Z的方向移动。正确。D.升高温度,化学平衡向吸热反应方向移动,该反应的正反应可能是放热反应,也可能是吸热反应。若为放热反应,则升高温度,平衡逆向移动,平衡常数减小;若为吸热反应,则化学平衡常数增大。错误。
考点:考查化学反应速率的计算、外界条件对化学反应速率、化学平衡的影响的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A.v(CO)=1.5 mol·L-1·min-1 | B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 | D.v(CO2)=1.1 mol·L-1·min-1 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) 2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
C.H2(g)+I2(g) 2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.2A(g)+B(s) 2C(g)ΔH>0 2C(g)ΔH>0 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.物质自身的性质 | D.催化剂的加入 |
下图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。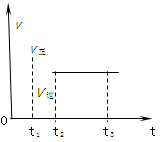
| A.t1时,只有正方向反应 |
| B.t2- t3,各物质的浓度不再发生变化 |
| C.t2- t3,反应不再发生 |
| D.t2时,反应未到达限度 |
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
| A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.上述生成Ni(CO)4(g)的反应为吸热反应 |
下列四种X溶液,均能跟盐酸反应,其中反应最快的是
| A.10℃ 20mL 3mol/L的X溶液 | B.20℃ 30mL 2molL的X溶液 |
| C.20℃ 10mL 4mol/L的X溶液 | D.10℃ 10mL 2mol/L的X溶液 |
2SO2+O2 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
| A.使用催化剂不影响反应速率 |
| B.降低体系温度能加快反应速率 |
| C.增加O2的浓度能加快反应速率 |
| D.一定条件下达到反应限度时SO2全部转化为SO3 |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |