题目内容
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
A
解析

练习册系列答案
相关题目
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.2mol/L | D.Z为0.4mol/L |
(6分)按要求回答下列问题
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是 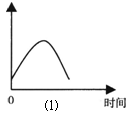
①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
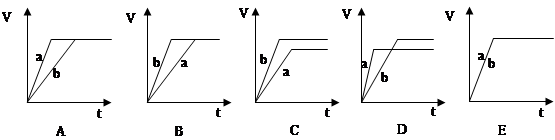
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
在生活、生产中为增大反应速率而采取的措施合理的是
| A.食物放在冰箱中 |
| B.塑料制品中添加抑制剂 |
| C.在糕点包装内放置小包除氧剂 |
| D.燃煤发电时用煤粉代替煤块 |
在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
| A.用相同浓度但温度较高的盐酸代替常温下的盐酸 |
| B.增大反应体系的压强或减小反应体系的压强 |
| C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙 |
| D.改用与原盐酸含有相同H+浓度的稀硫酸 |
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| | 改变条件 | 新平衡与原平衡比较 |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
下列有关说法正确的是
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.反应N2(g)+3H2(g) 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大 |
D.吸热反应“TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |