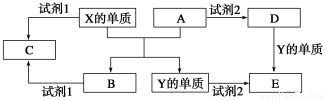
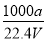题目内容
已知反应①:CO(g)+CuO(s)??CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=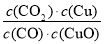
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小
B
【解析】在书写平衡常数表达式时,纯固体不能代入平衡常数表达式中,A错误。由于反应③=反应①-反应②,因此平衡常数K=K1/K2,B正确。反应③中,若温度升高,H2的浓度减小,说明平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误。对于反应③,反应前后气体体积不变,则在恒温恒容条件下,若充入与反应无关的稀有气体增大压强,平衡不移动,H2的浓度不变,D错误。

有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行如下实验:
实验步骤 | 实验现象 |
①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是______________;溶液中肯定不存在的离子是________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)________________________________________。
(3)写出实验⑤中所有反应的离子方程式:______________________________。