题目内容
【题目】某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤10t,计算:
(1)如果煤中的硫全部转化为SO2 , 每天可产生的SO2的质量为多少t;
(2)这些SO2在标准状况下的体积.
【答案】
(1)解:设每天可产生的SO2的质量为xt,根据硫元素守恒:
10t×0.32%=xt× ![]()
解得x=0.064
答:每天可产生的SO2的质量为0.064吨;
(2)解:二氧化硫物质的量为 ![]() =1000mol,故二氧化硫的体积为1000mol×22.4L/mol=2.24×104L,
=1000mol,故二氧化硫的体积为1000mol×22.4L/mol=2.24×104L,
答:SO2在标准状况下的体积为2.24×104L.
【解析】(1)根据硫元素守恒计算;(2)根据n= ![]() 计算二氧化硫物质的量,再根据V=nVm计算二氧化硫体积.
计算二氧化硫物质的量,再根据V=nVm计算二氧化硫体积.

【题目】A,B,C,D,E,F六种化合物,其中A,B,C,D,E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_______
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色,且用激光笔照射有丁达尔效应。 |
写出B与稀H2SO4反应的离子方程式________
写出②中反应的化学方程式________
(3)现由6种粒子Mn2+、MnO 4-、H+、H2O、X2Y 82-(C中含有的阴离子)、XY 42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO 4- 需氧化剂的物质的量为________ mol
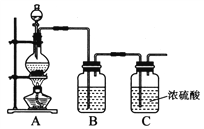
(4)化合物D和E相互转化D ![]() E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为________ g,ExH2O的化学式为________.
E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为________ g,ExH2O的化学式为________.