��Ŀ����
����Ŀ��(1)Na2S2O3����Ҫ�Ļ���ԭ�ϣ�������ˮ�������Ի���Ի������ȶ���
Ϊ�ⶨ��Ʒ���ȣ�����������ʵ�飺ȷ��ȡW g��Ʒ������������ˮ�ܽ⣬�Ե�����ָʾ������0.100 0 mol��L��1��ı���Һ�ζ���
��Ӧԭ��Ϊ��
2S2O![]() ��I2=S4O
��I2=S4O![]() ��2I��
��2I��
���ζ����յ�ʱ����Һ��ɫ�ı仯��_____________________________��
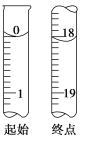
���ⶨ��ʼ���յ��Һ��λ����ͼ�������ĵ�ı���Һ���Ϊ________mL����Ʒ�Ĵ���Ϊ(��Na2S2O3��5H2O��Է�������ΪM)__________________ ______________��
(2)����I2�������Կɲⶨ��������ĺ����������ǽ������е���ת����H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ______________���ζ���Ӧ�����ӷ���ʽΪ__________________��
���𰸡�(1)������ɫ����ɫ
��18.10 ![]() ��100%
��100%
(2)���� I2��H2SO3��H2O=4H����2I����SO![]()
��������(1)���ζ��յ�ʱ�������ĵ��ʵ�ʹ��ɫ�ĵ�����Һ��������ָʾ�ζ��յ㡣����ʼ����Ϊ0.00 mL���յ����Ϊ18.10 mL���������ĵ�ı���Һ�����Ϊ18.10 mL��0.00 mL��18.10 mL������2Na2S2O3��5H2O��2S2O![]() ��I2����n(Na2S2O3��5H2O)��2n(I2)��2��0.100 0 mol��L��1��18.10��10��3L��3.620��10��3mol�����Ʒ�Ĵ��ȣ�
��I2����n(Na2S2O3��5H2O)��2n(I2)��2��0.100 0 mol��L��1��18.10��10��3L��3.620��10��3mol�����Ʒ�Ĵ��ȣ�![]() ��100%��
��100%��![]() ��100%��
��100%��
(2)�ⵥ����������Һ����ɫ�����������һ��I2��Һʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����˵����ζ��յ㡣��I2��2e����2I����H2SO3��2e����SO![]() �����ݵ�ʧ�������������I2��H2SO3���ٽ��ԭ���غ�͵���غ���ƽ��
�����ݵ�ʧ�������������I2��H2SO3���ٽ��ԭ���غ�͵���غ���ƽ��

