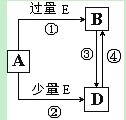
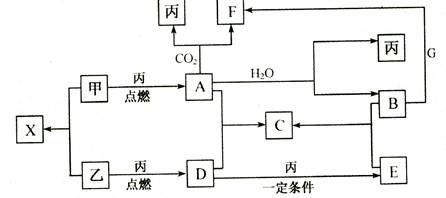
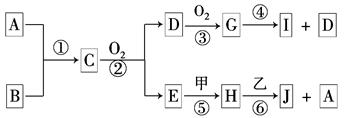
题目内容
(10分)T、X、Y、Z是中学化学常见的四种短周期元素,原子序数依次增大,其结构或性质信息如下表:
请根据信息回答有关问题(用具体元素符号或化学式作答)
(1)T、X、Y三种元素的电负性由大到小的顺序是 。
(2)写出元素Z基态原子的电子排布式 。
(3)X的氢化物分子间能形成氢键,Z的氢化物分子间不易形成氢键,试分析原因是 。
(4)分子HTX中,有 个 键, 个
键, 个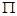 键。
键。
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体。基态原子的M层上有1个未成对p电子 |
(1)T、X、Y三种元素的电负性由大到小的顺序是 。
(2)写出元素Z基态原子的电子排布式 。
(3)X的氢化物分子间能形成氢键,Z的氢化物分子间不易形成氢键,试分析原因是 。
(4)分子HTX中,有 个
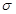 键, 个
键, 个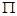 键。
键。(1)N > C > Na, (2)1S22S22P63S23P5,
(3)N的电负性较大,而原子半径较小, (4)2,2
(3)N的电负性较大,而原子半径较小, (4)2,2
根据元素的结构及有关性质可知,T、X、Y、Z分别是C、N、Na、Cl。
(1)非金属性越强,电负性越大,因此是N > C > Na。
(2)根据构造原理可知,Cl元素基态原子的电子排布式为1S22S22P63S23P5。
(3)由于N的电负性较大,而原子半径较小,所以氮元素能形成氢键,而氯元素不能。
(4)该物质是HCN,其中H和C之间形成的是单键,C和N之间是三键。三键是由1个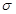 键和2个
键和2个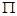 键构成的,所以该分子中含有个
键构成的,所以该分子中含有个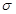 键,2个
键,2个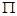 键。
键。
(1)非金属性越强,电负性越大,因此是N > C > Na。
(2)根据构造原理可知,Cl元素基态原子的电子排布式为1S22S22P63S23P5。
(3)由于N的电负性较大,而原子半径较小,所以氮元素能形成氢键,而氯元素不能。
(4)该物质是HCN,其中H和C之间形成的是单键,C和N之间是三键。三键是由1个
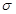 键和2个
键和2个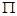 键构成的,所以该分子中含有个
键构成的,所以该分子中含有个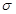 键,2个
键,2个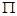 键。
键。
练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目

 是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子
是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子