题目内容
【题目】短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W元素的氧化物对应的水化物可能是弱电解质
C. X2Y2加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y形成含非极性键的分子
【答案】B
【解析】短周期元素X、Y、Z、W的原子序数依次增大,X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为![]() ,故Y为O元素,W为S元素。O2-与Na+的电子层结构相同,O2-的半径大于Na+,A错误;S元素的氧化物对应的水化物可能为亚硫酸,为弱电解质,B正确;当H2O2与强氧化剂酸性高锰酸钾溶液作用时,H2O2作还原剂,C错误;氢元素与氧元素形成H2O2 或H2O ,钠元素与氧元素形成Na2O2或Na2O,H2O2中含有非极性键,而Na2O2中含有非极性键,但是Na2O2属于离子化合物,不是共价化合物,无分子,D错误;正确选项B。
,故Y为O元素,W为S元素。O2-与Na+的电子层结构相同,O2-的半径大于Na+,A错误;S元素的氧化物对应的水化物可能为亚硫酸,为弱电解质,B正确;当H2O2与强氧化剂酸性高锰酸钾溶液作用时,H2O2作还原剂,C错误;氢元素与氧元素形成H2O2 或H2O ,钠元素与氧元素形成Na2O2或Na2O,H2O2中含有非极性键,而Na2O2中含有非极性键,但是Na2O2属于离子化合物,不是共价化合物,无分子,D错误;正确选项B。

 考前必练系列答案
考前必练系列答案【题目】卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(1)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,最适宜选用的物质是____(填序号,下同),加入______调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.KMnO4 b.H2O2 c.MgO d.NaOH
(2)若除去溶液中的杂质离子,调节溶液的pH范围为:___________。
(3)由MgCl2溶液获得MgCl2固体的操作是:__________________。
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的Na2SO3溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-6mol·L-1],此时溶液中c(SO32-)≤__________mol·L-1。
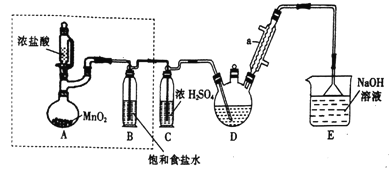
【题目】下列实验、现象及有关结论不正确的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | 加热铝箔,铝箔熔化却不滴落 | 石蜡油分解产生的气体能使试管中溴的四氯化碳溶液褪色 | 食盐水浸泡过的铁钉放入试管中,一段时间后,导管口形成一段水柱 | 向蔗糖中加人浓硫酸时,蔗糖变黑,体积膨胀 |
结论 | 氧化铝的熔点比铝的高 | 石蜡油的分解产物中含不饱和烃 | 铁钉发生吸氧腐蚀 | 浓硫酸具有吸水性和强氧化性 |
A. A B. B C. C D. D