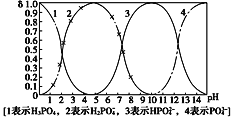
题目内容
【题目】在一密闭容器中进行反应:![]() ,已知反应过程中某一时刻
,已知反应过程中某一时刻![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A.![]() 为
为![]() 、
、![]() 为
为![]() B.
B.![]() 为
为![]()
C.![]() 为
为![]() 、
、![]() 为
为![]() D.
D.![]() 和
和![]() 均为
均为![]()
【答案】C
【解析】
![]() 为可逆反应,反应物不可能全部反应完,根据极值法,
为可逆反应,反应物不可能全部反应完,根据极值法,

可判断各物质浓度范围如下:N2(0,0.2)、H2(0,0.6)、NH3(0,0.4)。
A.反应不可能逆向进行到底,所以N2浓度小于0.2mol/L,H2浓度小于0.6 mol/L,A错误;
B.反应不可能正向进行到底,所以NH3浓度小于0.4mol/L,B错误;
C.N2浓度为0.15mol/L,说明要消耗NH3浓度为0.1mol/L,此时H2浓度为0.45mol/L,C正确;
D.若N2浓度为0.1 mol/L,则NH3浓度应为0.2mol/L,D错误;
故本题答案为C。

【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
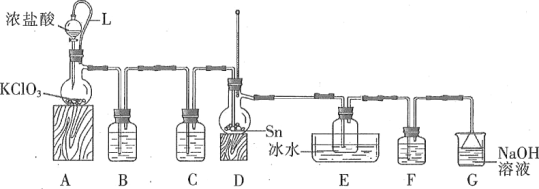
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
(4)F和G装置可以用下列装置代替的是____。(填代号)
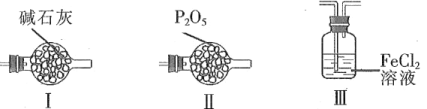
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。