题目内容
1.在298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-92.38kJ/mol. 在该温度下,取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是少于92.38kJ,其原因是该反应是可逆反应,原料气不可能完全反应,即l molN2和3molH2放在密闭容器中反应生成氨气小于2mol,放出的热量小于92.38kJ.分析 根据合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量.
解答 解:由反应N2(g)+3H2(g)?2NH3(g)△H=-92.38kJ/mol可知,生成2mol氨气时放出92.38kJ热量;l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.38kJ;
故答案为:该反应是可逆反应,原料气不可能完全反应,即l molN2和3molH2放在密闭容器中反应生成氨气小于2mol,放出的热量小于92.38kJ.
点评 本题考查了学生对可逆反应的理解,可以培养学生的分析、理解能力及灵活应用所学知识的能力,难度中等.

练习册系列答案
相关题目
11.“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂.下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
12.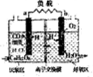 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )| A. | a电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 电流从右侧电极经过负载后流向左侧电极 | |
| D. | 常温下,用该电池电解一定量的饱和硫酸铜溶液(电极为惰性电极),其中水的电离平衡向左移动 |
9.足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,气体被水完全吸收.若向原所得溶液中加入5mol•L-1H2SO4溶液100mL,则继续溶解的Cu的质量为( )
| A. | 6.4g | B. | 9.6g | C. | 19.2g | D. | 24g |
16.下列有关离子键,共价键的叙述中正确的是( )
| A. | 离子化合物中只存在离子键,没有共价键 | |
| B. | 共价化合物分子中一定不存在离子键 | |
| C. | 构成单质的粒子中一定含有共价键 | |
| D. | 仅由非金属元素组成的化合物中一定不含离子键 |
6.下列反应的离子方程式正确的是澄清的石灰水跟盐酸反应( )
| A. | 澄清的石灰水跟盐酸反应2H++Ca(OH)2═H2O+Ca2+ | |
| B. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O | |
| D. | 金属钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
13.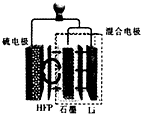 最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
 最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li---S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li═6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减小,阴极质量增加 | |
| C. | 放电时,正极的电极反应时为S62--10e-═6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
10.如图是铜锌原电池装置,下列有关叙述错误的是( )
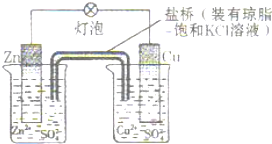

| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+2H+═Zn2++H2↑ | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向CuSO4溶液 |
11.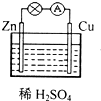 对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
 对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )
对于Zn、Cu和稀H2SO4组成的原电池(如图),下列有关说法正确的是( )| A. | Cu是负极 | B. | 在外电路中,电流由Zn流向Cu | ||
| C. | Zn电极上发生氧化反应 | D. | Cu极反应:Cu2++2e-═Cu |