题目内容
根据下面物质间转化的框图,回答有关问题;
`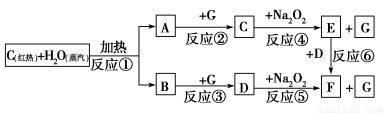
(1)由反应①产生的A、B混合物的工业名称是________。
(2)写出框图中D、E的化学式:D________;E________。
(3)如果2 mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是________L,同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(4)如果A、B混合气体7.8 g,在与G充分反应后,通过足量Na2O2层,可使Na2O2增重________g。
(1)水煤气
(2)CO2 NaOH
(3)22.4 2NA
(4)7.8
【解析】(1)由碳与水蒸气反应的产物成分可知,此混合物的工业名称为水煤气。
(2)由图中信息及E+D―→F可推知,A为氢气,B为CO,故E为NaOH,D为CO2。(3)由化学方程式:2Na2O2+2H2O=4NaOH+O2↑可知,若2 mol Na2O2参加反应,则生成1 mol氧气,在标准状况下体积为22.4 L;同时有2 mol电子发生转移。(4)由2H2+O2=2H2O及2Na2O2+2H2O=4NaOH+O2↑可推知:过氧化钠增加的质量为氢气的质量;由2CO+O2=2CO2及2Na2O2+2CO2=2Na2CO3+O2可推知:过氧化钠增加的质量为CO的质量,故二者不管比例如何,它们通过Na2O2充分反应后,过氧化钠增加的质量即是氢气和一氧化碳的质量,为7.8 g。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目