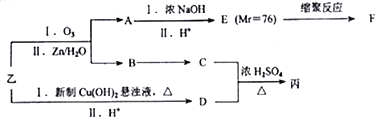
题目内容
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_______________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)=CH3OH(g) △H 。在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图。

①在上图A、B、C三点中,选填下表物理且对应最大的点。
反应速率 | 平衡常数K | 平衡转化率a |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,该反应向_________方向进行(城“正反应”、‘逆反应”或“不移动”)。
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系如图所示,测得D点氢气的转化率为40%,则x=_____________。

(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[ c(Fe3+)≤4×l0-19]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38〕
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓NaOH 溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如下图所示。

则A溶液中溶质的成分为___________________(填化学式);阳极的电极反应式为_____________
【答案】 Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g)△H=-23.5 kJ![]() mol-1 C AB A 正反应 3 3 ≤ pH ≤ 5 NaOH Fe- 6e- + 8OH- = FeO42- + 4H2O
mol-1 C AB A 正反应 3 3 ≤ pH ≤ 5 NaOH Fe- 6e- + 8OH- = FeO42- + 4H2O
【解析】(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol ,③4Fe(s)+3O2(g)=2Fe2O3(g) △H3=-1651.0kJ/mol,根据盖斯定律由①×![]() -②×
-②×![]() -③×
-③×![]() 可得Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g),则△H=(-393.5kJ/mol)×
可得Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g),则△H=(-393.5kJ/mol)×![]() -(+172.5kJ/mol)×
-(+172.5kJ/mol)×![]() -(-1651.0kJ/mol)×
-(-1651.0kJ/mol)×![]() =-23.5 kJ
=-23.5 kJ![]() mol-1 ,故
mol-1 ,故
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-23.5 kJ![]() mol-1 ;
mol-1 ;
(2)①由图可知,升高温度,CH3OH的体积分数减小,平衡逆向移动,则该反应的△H<0,300℃时,增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,温度越高反应速率越快,反应速率最高的为C点,温度升高平衡逆向移动,则化学平衡常数减小,则AB点平衡常数相等且大于C点;温度高反应物的转化率降低,压强增大反应物的转化率升高,则A点为低温高压,故A点转化率最高;
② CO(g)+2H2(g)=CH3OH(g)
起始时(mol)1 2 0
变化(mol) 0.5 1 0.5
平衡(mol) 0.5 1 0.5
现在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的CH3OH,相当于恒容条件下将两个平衡状态相加,平衡向体积减小的方向进行,即正向进行;
③D点时H2的转化率为40%,CO的转化率为60%,设起始时H2为amol,变化量为0.4amol,CO超始量为bmol,变化量为0.6bmol,则0.4amol:0.6bmol=2:1,则a:b=3:1,则x=[n(H2)/n(CO)]=a:b=3:1=3;
(3)根据KspFe(OH)3=4×l0-38,当Fe3+完全沉淀[ c(Fe3+)≤4×l0-5]时c(OH-)=![]() =10-11mol/L,此时溶液pH=3,当Cu2+开始沉淀时,根据KspCu(OH)2=2.6×l0-19,c(OH-)=
=10-11mol/L,此时溶液pH=3,当Cu2+开始沉淀时,根据KspCu(OH)2=2.6×l0-19,c(OH-)=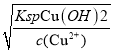 =10-9mol/L,此时溶液pH=5,则需控制溶液pH的范围为3 ≤ pH ≤ 5 ;
=10-9mol/L,此时溶液pH=5,则需控制溶液pH的范围为3 ≤ pH ≤ 5 ;
(4)电解池的左侧连接电源负极为阴极,电解池工作时阴极发生还原反应,溶液中的H+(来源于水的电离)生成H2,促进水的电离产物大量OH-,OH-不能透过阳离子交换膜进入阳极室,则A流出的溶液为NaOH;阳极发生氧化反应,Fe失电子在碱性条件下被氧化为FeO42-,电极反应式为Fe- 6e- + 8OH- = FeO42- + 4H2O。

 期末集结号系列答案
期末集结号系列答案【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
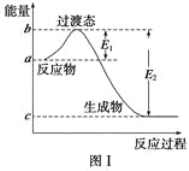
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。