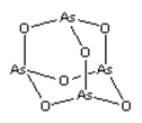
题目内容
【题目】环戊二烯(![]() )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )

A.T1>T2
B.b点时二聚体的浓度为0.45mol·L-1
C.a点的正反应速率小于b点的逆反应速率
D.a点的反应速率小于c点的反应速率
【答案】B
【解析】
环戊二烯(![]() )容易发生聚合生成二聚体,通过外界因素对反应速率的影响和平衡状态的形成进行分析。
)容易发生聚合生成二聚体,通过外界因素对反应速率的影响和平衡状态的形成进行分析。
A. 温度越高,反应速率越快,单位时间内反应物减少越多,故T2>T1,A错误;
B. b点时环戊二烯的浓度1.5mol/L降低至0.6mol/L,减少了0.9mol/L,故二聚体的浓度为0.45mol·L-1,B正确;
C. a点、b点反应一直正向进行,故v正>v逆,a点反应物浓度大于b点,故a点正反应速率大于b点的逆反应速率,C错误;
D. 温度越高,反应速率越快,故a点的反应速率大于c点的反应速率,D错误。
答案为B。

【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka__(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是__(填序号);
a.CO![]() b.ClO-c.CH3COO-d.HCO
b.ClO-c.CH3COO-d.HCO![]()
(3)下列反应不能发生的是__(填序号)
a.CO![]() +CH3COOH=CH3COO-+CO2↑+H2O
+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO![]() +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO![]() +2HClO
+2HClO
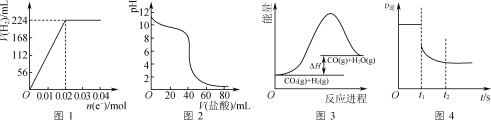
(4)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数__(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)__醋酸溶液中水电离出来的c(H+),理由是___。
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
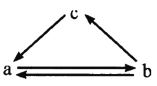
选项物质 | a | b | c |
A | Na2 CO3 | NaHCO3 | CO2 |
B | NO | NO2 | HNO3 |
C | FeCl3 | FeCl2 | Fe |
D | Al2O3 | Al(OH)3 | AlCl3 |
A.AB.BC.CD.D