题目内容
【题目】高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( ) 
A.铁是阳极,电极反应为Fe﹣6e﹣+4H2O═FeO42﹣+8H
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH﹣自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
【答案】D
【解析】解:A、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O,故A错误;B、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极,故B错误;
C、阴离子交换膜只允许阴离子通过;阴离子移向阳极,应从左向右移动,故C错误;
D、阳极区域,铁失电子消耗氢氧根离子,溶液PH减小,阴极区氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,溶液PH增大;生成氢氧根离子物质的量消耗,在阳极电极反应Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O,阴极氢氧根离子增大,电极反应2H++2e﹣=H2↑,依据电子守恒分析,氢氧根离子消耗的多,生成的少,所以溶液pH降低,故D正确;
故选D.

【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。
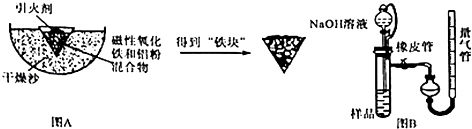
【题目】某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):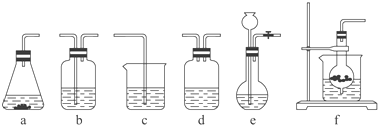
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
分项 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置(填序号) | c | ||
选择的药品(填序号) | ① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: .
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 , Y装置中除去的杂质为 .
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是 .
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过%(质量分数).附:有关物质在常温(25℃)时的溶解度
化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |