题目内容
【题目】铝热反应是铝的一个重要性质.某校化学兴趣小组同学为了克服传统铝热反应纸漏斗易燃烧,火星四射等缺点,将实脸改成以下装置,取磁性氧化铁在如图A实验进行铝热反应,冷却后补到“铁块”混合物.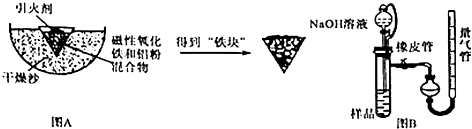
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是 .
(2)该铝热反应的化学方程式为 .
(3)取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气体体积以测量样品中残留铝的百分含量.试回答下列问题:①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 .
②量气管在读数时必须进行的步骤是 .
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为 .
④装置中分液漏斗上端和烧瓶用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用.如果装置没有橡胶管,测出铝的百分含量将会(填“偏大”或“偏小”).
【答案】
(1)蔗糖在浓硫酸中脱水并放出大量的热
(2)8Al+3Fe3O4 ![]() 4Al2O3+9Fe
4Al2O3+9Fe
(3)碱式滴定管;冷却至常温和调节量气管使左右液面相平;3.6%;偏大
【解析】解:(1)因为把浓硫酸加入到蔗糖中发生脱水并放出大量的热,可作引火剂,所以答案是:蔗糖在浓硫酸中脱水并放出大量的热;(2)Al还原Fe3O4生成Fe和Al2O3 , 由原子守恒可得化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe,所以答案是:8Al+3Fe3O4
4Al2O3+9Fe,所以答案是:8Al+3Fe3O4 ![]() 4Al2O3+9Fe;(3)滴入足量NaOH溶液充分反应,测量生成气休体积以测量样品中残留铝的百分含量,由图可知,量气管测定氢气的体积,①因为该仪器盛放NaOH溶液,所以由碱式滴定管改装而成,所以答案是:碱式滴定管;②因为气体的体积受温度和压强影响,所以量气管在读数时必须进行的步骤是:冷却至常温和调节量气管使左右液面相平,所以答案是:冷却至常温和调节量气管使左右液面相平;③根据Al与NaOH溶液反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,m(Al)=n(Al)×27g/mol=
4Al2O3+9Fe;(3)滴入足量NaOH溶液充分反应,测量生成气休体积以测量样品中残留铝的百分含量,由图可知,量气管测定氢气的体积,①因为该仪器盛放NaOH溶液,所以由碱式滴定管改装而成,所以答案是:碱式滴定管;②因为气体的体积受温度和压强影响,所以量气管在读数时必须进行的步骤是:冷却至常温和调节量气管使左右液面相平,所以答案是:冷却至常温和调节量气管使左右液面相平;③根据Al与NaOH溶液反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,m(Al)=n(Al)×27g/mol= ![]() 3n(H2)×27g/mol=
3n(H2)×27g/mol= ![]() ×0.0448L÷22.4L/mol×27g/mol=0.036g,则铝的百分含量为
×0.0448L÷22.4L/mol×27g/mol=0.036g,则铝的百分含量为 ![]() ×100%=3.6%,所以答案是:3.6%;④如果装置没有橡胶管,烧瓶内压强增大,造成气体读数偏大,则铝的百分含量将会偏大,所以答案是:偏大.
×100%=3.6%,所以答案是:3.6%;④如果装置没有橡胶管,烧瓶内压强增大,造成气体读数偏大,则铝的百分含量将会偏大,所以答案是:偏大.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案