题目内容
【题目】某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
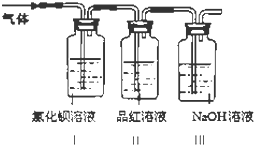
仪器装置(如图所示):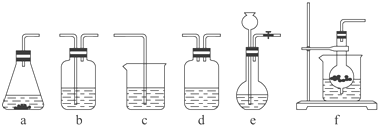
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
分项 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置(填序号) | c | ||
选择的药品(填序号) | ① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: .
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 , Y装置中除去的杂质为 .
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是 .
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过%(质量分数).附:有关物质在常温(25℃)时的溶解度
化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
【答案】
(1)f;b;②⑥;④
(2)方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好
(3)CaCO3+2H+═Ca2++CO2↑+H2O;HCl
(4)使溶液中的NaOH完全转化为NaHCO3
(5)4.37
【解析】解:(1)装置f在制取气体时打开开关,由于装置内外压强相等,液体药品会从下端的管进入装置内,与装置内固体接触,反应开始,当关闭开关后,由于产生的气体不能排出,试管内气体压强越来越大,把液体从下端的管口压出,是液体与固体分离,反应停止,所以可以做到随开随用随关随停,所以用装置f制取CO2气体,然后再通过盛有饱和KHCO3溶液的b装置以除去CO2中混有的HCl(原理是:KHCO3+HCl═KCl+CO2↑+H2O),最后再将足量的CO2通入稀NaOH溶液中即可(原理是:CO2+NaOH═NaHCO3),所以答案是:
分项 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置(填序号) | f | b | c |
选择的药品(填序号) | ②⑥ | ④ | ① |
2)检验装置f的气密性,方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好,所以答案是:方案1:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好 方案2:塞紧单孔塞,关闭活塞,在烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好;(3)碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,所以装置f中发生化学反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,氯化氢易挥发,Y装置中除去的杂质为氯化氢,所以答案是:CaCO3+2H+═Ca2++CO2↑+H2O;HCl;(4)少量二氧化碳和氢氧化钠反应:CO2+2NaOH═Na2CO3+H2O,过量二氧化碳和氢氧化钠反应CO2+NaOH═NaHCO3 , 常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是使溶液中的NaOH完全转化为NaHCO3 , 所以答案是:使溶液中的NaOH完全转化为NaHCO3;(5)假设NaHCO3的饱和溶液中含100 g水,则由提供数据可知,此时溶液中NaHCO3的质量为9.60 g,据反应CO2+NaOH═NaHCO3可求得NaOH的质量为: ![]() =4.57 g,所以,NaOH溶液最大浓度w(NaOH)=
=4.57 g,所以,NaOH溶液最大浓度w(NaOH)= ![]() ×100%=4.37%,
×100%=4.37%,
所以答案是:4.37.