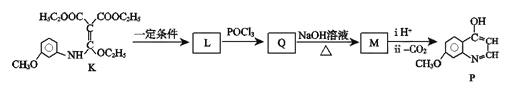
题目内容
【题目】用NA表示阿伏伽德罗常数,下列各选项中正确的是( )
A.1mol/L Na2CO3溶液中的Na+数目为2NA
B.等质量的NO2和N2O4,前者原子数小
C.1L 0.1mol/L NaHCO3溶液中含氧原子数0.3NA
D.常温常压下,0.2mol CO2的体积大于4.48L
【答案】D
【解析】
A.缺少溶液的体积,不能计算微粒数目,A错误;
B.假设物质的质量都是mg,则mg NO2含有的原子的物质的量是n=![]() ×3=
×3=![]() mol;mgN2O4含有的原子的物质的量是n=
mol;mgN2O4含有的原子的物质的量是n=![]() ×6=
×6=![]() mol,二者的物质的量相等,原子数目也相等,B错误;
mol,二者的物质的量相等,原子数目也相等,B错误;
C.不仅溶质中含有O,溶剂水中也含有O,所以1L 0.1mol/L NaHCO3溶液中含氧原子数大于0.3NA,C错误;
D.温度升高,气体体积增大,由于在常温常压下,气体摩尔体积大于22.4L/mol,所以0.2mol CO2的体积大于4.48L,D正确;
故合理选项是D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。
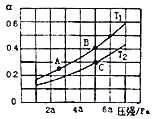
a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
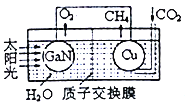
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。