��Ŀ����
����Ŀ���Ƚ���գ��>������<��������
��1���Ƚϵ������Ũ�ȵ���Һ������ �ڴ��� ������п����Ӧ����������������� ��
�Ƚ�2H2(g)��O2(g)![]() 2H2O(g) ��H 1 2H2(g)��O2(g)
2H2O(g) ��H 1 2H2(g)��O2(g)![]() 2H2O(l) ��H2�ķ�Ӧ�� ��H1 ��H2
2H2O(l) ��H2�ķ�Ӧ�� ��H1 ��H2
�Ƚϳ���������Һˮ�ĵ���̶ȣ���pH=4���� ��pH =10��ˮ��Һ�� ��
����ͬ�¶�����Һ��ʹ���ȳ��ֺ�ɫ����Һ��ʹʯ�������ɫ���Ƚ�����pH�� ��
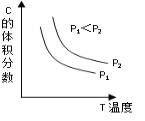
��2��������֪ij���淴ӦaA(g) + bB(g) ![]() cC(g) + dD(g)����Ӧ�����У���������������ʱ��C������������¶�(T)��ѹǿ(P)�Ĺ�ϵ����ͼ����a + b c + d
cC(g) + dD(g)����Ӧ�����У���������������ʱ��C������������¶�(T)��ѹǿ(P)�Ĺ�ϵ����ͼ����a + b c + d
�����ȽϢ�0.1mol/L�������0.01mol/L����ĵ����������� ��
����1mol/L��ˮ��0.1mol/L��ˮ��c(OH-)֮�� 10
���������ͬ�ĺ����ܱ���������A�г���SO2��O2��1g����B�г���SO2��O2��2g����ͬ�����·�����Ӧ2SO2+O2![]() 2SO3 ƽ��ʱ SO2��ת����A B
2SO3 ƽ��ʱ SO2��ת����A B
���𰸡�= �� = �� �� �� �� ��
��������
�����������1���������Ũ�ȵ�����ʹ��������ʵ����ʵ�����ȣ����߾�ΪһԪ�ᣬ������п����Ӧ����������������������=������ȼ��Ϊ���ȷ�Ӧ���ų�������Խ�࣬��HԽС����̬ˮת��ΪҺ̬ˮ���ȣ��ʺ��߷ų��������࣬����Ӧ�� ��H 1>��H2��������Һ����ˮ�ĵ��룬������Һ��������Ũ�ȣ�pH=4������������Ũ��Ϊ1��10-10mol/L������Һ����ˮ�ĵ��룬������Һ��������Ũ�ȣ�pH =10��ˮ��������Ũ��Ϊ1��10-10mol/L��������������Һˮ�ĵ���̶ȣ���= �����������ȵı�ɫ��ΧΪ3.1����4.4��ʯ��ı�ɫ��ΧΪ5����8����ͬ�¶�����Һ��ʹ���ȳ��ֺ�ɫ����Һ��ʹʯ�������ɫ������pH����<����
��2��������ͼ��֪�¶���ͬʱ����ѹǿC�������������ƽ�������ƶ���������Ϊ�������ʵ�����С�ķ�Ӧ����a + b> c + d��������Һ�ĵ�����ȡ������Һ�������ƶ����ӵ�Ũ�ȣ�����0.1mol/L�������0.01mol/L����ĵ�����������> ��������Ũ��Խ��������ʵĵ���̶�ԽС����1mol/L��ˮ��0.1mol/L��ˮ��c(OH-)֮��<10�����������ͬ�ĺ����ܱ���������A�г���SO2��O2��1g����B�г���SO2��O2��2g��B���൱����A�Ļ���������ѹǿ��ƽ�������ƶ���SO2��ת��������ƽ��ʱ SO2��ת����A<B��

����Ŀ����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״�:
CO(g) +2H2(g) ![]() CH3OH(g) ��H =-90.8 kJ��mol-1
CH3OH(g) ��H =-90.8 kJ��mol-1
300��ʱ�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | �� | �� | �� | |
��Ӧ��Ͷ���� | 1 molCO��2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
ƽ�� ʱ ���� | CH3OH��Ũ��(mol��L-1) | c1 | c2 | c3 |
��Ӧ�������仯 | a kJ | bkJ | ckJ | |
��ϵѹǿ(Pa) | p1 | p2 | p3 | |
��Ӧ��ת���� | a1 | a2 | a3 | |
����˵����ȷ����
A. 2c1>c3 B. �Oa�O+�Ob�O=90.8
C. 2p2<p3 D. a1+ a3<1
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺
����\�� | ��A | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
(1)�ݡ��ޡ��ߵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_________________����Ԫ�ط��ţ������ǵ�����������Ӧˮ����ļ��Դ�ǿ������˳��Ϊ______________��������������Ӧˮ����Ļ�ѧʽ����
(2)�ڡ��ࡢ�����ۺ������������ǿ������˳����__________________������ۺ�����Ļ�ѧʽ����
(3)�١��ܡ�������Ԫ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ��__________________��
(4)�ɱ��Т١�������Ԫ�ص�ԭ�ӿɰ�1��1��ɵ�һ�ֳ���Һ̬�������Һ̬������ĵ���ʽΪ��__________________����д����Һ̬��������MnO2�������·ֽ�Ļ�ѧ����ʽ____________
(5)���Ǽ��õİ뵼����ϣ�����������ڸ��µ�����������һ�������������մɲ��ϣ���д�������Ӧ�Ļ�ѧ����ʽ��__________________��
