题目内容
已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×l0-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH—)+ c(HCO3-) +2c(CO32-)
【答案】
D
【解析】根据电离常数可知,酸性强弱顺序是醋酸>碳酸>HCN>HCO3-。因为酸越弱,相应但钠盐越溶液水解,碱性越强,所以A不正确,应该是pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)。B中溶液中c(Na+)>c(CN-),说明溶液显碱性,恰好反应时溶液也显碱性,所以B不正确。稀释促进电离,所以氢离子的物质的量始终是增加的,C不正确。D正确,符合电荷守恒,答案选D。

练习册系列答案
相关题目
已知25℃时有关弱酸的电离平衡常数:
|
已知25℃时有关弱酸的电离平衡常数:
|
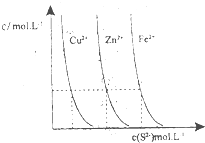 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: